Hvorfor danner kulstof en kovalent binding?
* Elektronisk konfiguration: Carbon har 4 valenselektroner (elektroner i sin yderste skal). Det har brug for 4 flere elektroner for at opnå en stabil oktetkonfiguration som de ædle gasser.
* Elektronegativitet: Carbon har en moderat elektronegativitet. Det er ikke stærkt nok til at trække elektroner væk fra andre atomer for at danne ioniske bindinger, og det er heller ikke svagt nok til let at miste sine egne elektroner.
Hvorfor kovalente obligationer er løsningen:
* deling er omsorgsfuld: Kovalente bindinger giver kulstof mulighed for at dele sine 4 valenselektroner med andre atomer, afslutte sin oktet og opnå stabilitet.
* Stærke obligationer: Kovalente bindinger er relativt stærke, hvilket fører til stabile molekyler.
* alsidighed: Evnen til at danne 4 kovalente bindinger giver kulstof mulighed for at skabe en enorm række komplekse molekyler, der danner rygraden i organisk kemi og selve livet.
Kortfattet: Carbon's elektroniske konfiguration og elektronegativitet gør den ideel til at danne stærke, stabile kovalente bindinger, så det kan skabe det store og forskellige udvalg af organiske forbindelser, som vi ser rundt omkring os.
Sidste artikelHvilken farve er skyggen af kobolt?
Næste artikelHvad er massen på 9 mol natrium?
 Varme artikler
Varme artikler
-
 MOF co-katalysator tillader selektivitet af forgrenede aldehyder på op til 90 %Mikroporer af MOFer med visse topologier øger tætheden af olefinerne, mens de delvist forhindrer adsorptionen af syntesegassen. Kredit:@PSI Bestræbelser på at udvikle heterogene katalysatorer,
MOF co-katalysator tillader selektivitet af forgrenede aldehyder på op til 90 %Mikroporer af MOFer med visse topologier øger tætheden af olefinerne, mens de delvist forhindrer adsorptionen af syntesegassen. Kredit:@PSI Bestræbelser på at udvikle heterogene katalysatorer, -
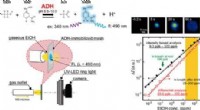 Sniff-cam for at opdage sygdomKredit:American Chemical Society At have dårlig ånde kan betyde, at nogen spiste en ildelugtende frokost, men det kan indikere, at personen er syg. Forskellige duftforbindelser er blevet forbundet
Sniff-cam for at opdage sygdomKredit:American Chemical Society At have dårlig ånde kan betyde, at nogen spiste en ildelugtende frokost, men det kan indikere, at personen er syg. Forskellige duftforbindelser er blevet forbundet -
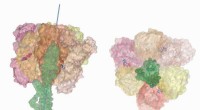 Titan -supercomputer analyserer bakterielt fotosyntetisk systemATP-hydrolysedrevet rotation af den centrale stilk i ATP-syntasen af V-typen af bakterierne Enterococcus hirae skildrer kemomekanisk kobling af molekylmotoren. Disse simuleringer blev udført på Ti
Titan -supercomputer analyserer bakterielt fotosyntetisk systemATP-hydrolysedrevet rotation af den centrale stilk i ATP-syntasen af V-typen af bakterierne Enterococcus hirae skildrer kemomekanisk kobling af molekylmotoren. Disse simuleringer blev udført på Ti -
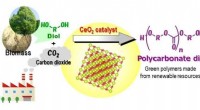 Verdens første grønne syntese af plast fra CO2Direktør 2 katalyserer den direkte polymerisation af flow CO 2 og dioler til tilvejebringelse af polycarbonatdioler i høje udbytter, som er nyttige kemikalier til polyestere, polyurethaner, og akr
Verdens første grønne syntese af plast fra CO2Direktør 2 katalyserer den direkte polymerisation af flow CO 2 og dioler til tilvejebringelse af polycarbonatdioler i høje udbytter, som er nyttige kemikalier til polyestere, polyurethaner, og akr
- Der er fundet beviser for overfluiditet i ekstremt kolde 2D -gaser af fermioner
- Hvad er de 5 dværgplaneter navne i solsystemet?
- Leder natriumbromid elektricitet i flydende tilstand?
- Nye rytterdata viser, hvordan offentlig transport reducerer udledningen af drivhusgasser og forure…
- Kan hunde spise agurker? Er de sikre? Deres sundhedsmæssige fordele forklaret
- Er farven på et bladlys relficeret eller absorberet?


