Titan -supercomputer analyserer bakterielt fotosyntetisk system
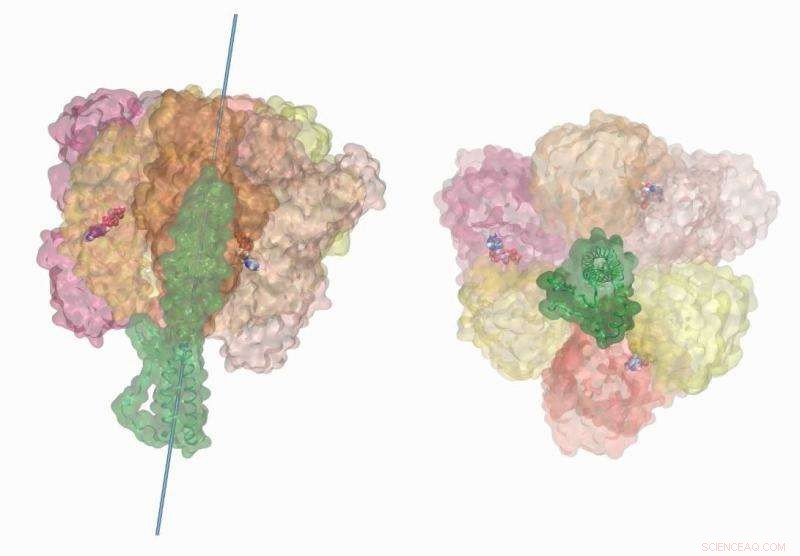
ATP-hydrolysedrevet rotation af den centrale stilk i ATP-syntasen af V-typen af bakterierne Enterococcus hirae skildrer kemomekanisk kobling af molekylmotoren. Disse simuleringer blev udført på Titan supercomputeren ved hjælp af NAMD2.12. Visualisering og filmgengivelse blev fuldført på VMD1.9.3. Kredit:Barry Isralewitz, University of Illinois i Urbana-Champaign
På trods af den store mangfoldighed blandt levende organismer, det molekyle, der bruges til at lagre og overføre energi inden for aerob, eller iltforbrugende, celler er bemærkelsesværdigt det samme. Fra bakterier til svampe, planter, og dyr, adenosintrifosfat (ATP) tjener som livets universelle energivaluta, giver næring til de processer, celler har brug for for at overleve og fungere.
I løbet af en dag, en person vil typisk bruge det, der svarer til hans eller hendes kropsvægt i ATP; imidlertid, den menneskelige krop bærer kun en lille mængde af molekylet på ethvert tidspunkt. Det betyder, at celler konstant skal genbruge eller genopbygge deres begrænsede kapacitet, afhængig af en højeffektiv molekylær motor kaldet ATP-syntase til at udføre arbejdet.
Som en del af et projekt dedikeret til modellering af, hvordan encellede lilla bakterier gør lys til mad, et team af beregningsforskere fra University of Illinois i Urbana-Champaign (UIUC) simulerede en komplet ATP-syntase i detaljer med alle atomer. Arbejdet bygger på projektets første fase - en fotosyntetisk organel på 100 millioner atomer kaldet en kromatofor - og giver videnskabsmænd et hidtil uset indblik i en biologisk maskine, hvis energieffektivitet langt overgår ethvert kunstigt system.
Først foreslået under ledelse af afdøde Klaus Schulten, en pioner inden for beregningsbiofysik og grundlæggeren af Theoretical and Computational Biophysics Group ved UIUC, forskningen har udviklet sig under ledelse af Abhishek Singharoy, co-principal investigator og en National Science Foundation postdoc-stipendiat ved UIUC's Center for Physics of Living Cells.
Ud over Singharoy, holdet omfatter medlemmer fra grupperne af UIUC professorer Emad Tajkhorshid, Zaida Luthey-Schulten og Aleksei Aksimentiev; forsker Melih Sener; og udviklere Barry Isralewitz, Jim Phillips, og John Stone. Den eksperimentelle samarbejdspartner Neil Hunter fra University of Sheffield i England deltog også i projektet.
Det UIUC-ledede team byggede og testede sin megamodel under en flerårig tildeling tildelt gennem programmet Innovative and Novel Computational Impact on Theory and Experiment på Titan-supercomputeren, en Cray XK7 administreret af det amerikanske energiministeriums (DOE's) Oak Ridge Leadership Computing Facility (OLCF), en DOE Office of Science User Facility placeret på DOE's Oak Ridge National Laboratory.
Ved at bruge Titan, holdet producerede et virtuelt værktøj, der i nøjagtige detaljer kan forudsige den kemiske energiproduktion fra et fotosyntetisk system baseret på mængden af absorberet sollys. Forskningen kan en dag bidrage til avanceret ren energiteknologi, der inkorporerer biologiske koncepter.
"Naturen har designet kromatoforen på en sådan måde, at den kan generere nok ATP'er til, at disse bakterier kan overleve i svagt lys miljøer såsom bunden af damme og søer, " sagde Singharoy. "Vores arbejde fangede denne energiomdannelsesproces i alle-atomer detaljer og gjorde det muligt for os at forudsige dens effektivitet."
Lys i bevægelse
Ofte omtalt som cellens kraftværk, ATP-syntase er et komplekst enzym, der fremskynder syntesen af dets molekylære forstadier, adenosindiphosphat (ADP) og fosfat. Indlejret i kromatoforens indre og ydre membran, den enzymatiske motor består af tre hoveddele - en iondrevet rotor, en central stilk, og en proteinring.
Svarende til et vandhjul, der drejes af kraften fra en strømmende strøm, ATP-syntaserotoren udnytter den elektrokemisk ansporede bevægelse af ioner, såsom protoner eller natrium, fra høj koncentration til lav koncentration over membranen. Den resulterende mekaniske energi overføres til den centrale stilk, som hjælper proteinringen med at syntetisere ATP.
Bemærkelsesværdigt, processen fungerer lige så godt omvendt. Når for mange ioner opbygges på ydersiden af kromatoforen, ATP -syntaseproteinringen vil nedbryde ATP til ADP, en proces kaldet hydrolyse, og ioner vil strømme tilbage til indersiden.
"Normalt, du ville forvente et stort energitab under denne proces, som i enhver menneskeskabt motor, men det viser sig at ATP-syntase har meget lidt affald, "Singharoy sagde. "Hvordan denne motor er designet til at minimere energitab er det spørgsmål, vi begyndte at stille."
I lighed med en tømmermand, der skiller en motor ad for bedre at forstå, hvordan den fungerer, Singharoys hold nedbrød de 300, 000-atom enzym i dets bestanddele. Med udgangspunkt i årtiers forskning i ATP-syntase, tidligere modeller, og nye eksperimentelle data leveret af et japansk team ledet af Takeshi Murata fra RIKEN Center for Life Science Technologies, holdet konstruerede og simulerede brikkerne i ATP-syntase-puslespillet uafhængigt og sammen på Titan.
For at fange vigtige processer, der udspiller sig over millisekunders tidsskalaer, Singharoy, i samarbejde med Christophe Chipot fra det franske nationale center for videnskabelig forskning og Mahmoud Moradi fra University of Arkansas, implementerede molekylær dynamikkoden NAMD strategisk. Holdet udførte en ensemblestrategi, sporing af bevægelsen på omkring 1, 000 replikaer af ATP-syntase samtidigt med tidstrin på 2 femtosekunder, eller 2, 000 billioner af et sekund. I alt, holdet akkumulerede 65 mikrosekunder (65 milliontedele af et sekund) af simuleringstid, bruge denne information til at ekstrapolere bevægelser, der opstår i løbet af et millisekund (1 tusindedel af et sekund).
Som resultat, holdet identificerede tidligere udokumenterede drejebevægelser i proteinringen, der hjælper med at forklare den molekylære motors effektivitet. Tilsvarende holdets simuleringer fangede den elastiske elastik af enzymets centrale stilk. Singharoy's team vurderede, at når det blev parret med proteinringen, stilken absorberer omkring 75 procent af den energi, der frigives under hydrolyse.
Derudover simuleringer af proteinringen i sig selv afslørede en enhed, der kan fungere uafhængigt, et fund rapporteret i eksperimenter, men ikke i beregningsmæssige detaljer. "Selv i fravær af midterstilken, selve proteinringen er i stand til ATP-hydrolyse. Det er ikke særlig effektivt, men det har evnen, " sagde Singharoy.
Det store billede
Efter at have simuleret dens komplette ATP-syntasemodel, UIUC -teamet inkorporerede enzymet i sin tidligere konstruerede kromatoformodel for at få det mest omfattende billede af et fotosyntetisk system til dato.
Med dette virtuelle biologiske solpanel, holdet kunne måle hvert trin i energiomdannelsesprocessen – fra lys høst, til elektron- og protonoverførsel, til ATP-syntese - og bedre forstå dens mekaniske fundament.
Naturens kromatofor er designet til svag lysintensitet, absorberer kun mellem 3 og 5 procent af sollys på en typisk dag. Holdet, gennem Seners indsats, fandt ud af, at denne absorptionshastighed oversættes til omkring 300 ATP'er pr. sekund, hvilket er den mængde en bakterie skal bruge for at holde sig i live.
Efter at have studeret naturens design, holdet ville nu se om det kunne forbedre det. Forudsat den samme mængde lysintensitet, holdet designede en kunstig kromatofor med en decideret unaturlig proteinsammensætning, øge tilstedeværelsen af to typer specialiserede proteiner. Analyse af det nye design forudsagde en tredobling af det fotosyntetiske systems ATP-produktion, åbner mulighed for kromatoforens menneskestyrede optimering.
"Du kan potentielt genetisk modificere en kromatofor eller ændre dens koncentration af proteiner, " sagde Singharoy. "Disse forudsigelser lover at frembringe nye udviklinger inden for kunstig fotosyntese."
Under sin seneste INCITE-allokering, UIUC -teamet drejer sig om energiomdannelse i en anden livsform:dyr. Ved at tage det, den har lært af modellering af fotosyntese i lilla bakterier, holdet modellerer cellulær respiration, den proces dyreceller bruger til at omdanne næringsstoffer til ATP.
"Du har mindst to proteiner til fælles mellem respiration og fotosyntese, " sagde Singharoy, som fortsætter sit engagement i projektet som adjunkt ved Arizona State University. "Spørgsmålet er, hvilke designprincipper, der overføres til højere organismer?"
Livet på stedet
Simulering af kromatoforen - komplet med ATP-syntase - markerer et igangværende skift i beregningsbiofysik fra at analysere individuelle celledele (f.eks. enkelte proteiner og hundredvis af atomer) til at analysere hele cellesystemer (f.eks. hundredvis af proteiner og millioner af atomer).
Schulten, der døde i oktober 2016, forstod bedre end de fleste andre betydningen af at bruge computere til at simulere naturen. I et interview i 2015, han lagde sin begrundelse for modellering af kromatoforen. "Motivationen er at forstå et meget vigtigt skridt i livet på Jorden, som alt liv afhænger af i dag. Energimæssigt afhænger 95 procent af livet på Jorden af fotosyntese, inklusive mennesker, " han sagde.
Schulten forstod også milepælen en specialiseret organel repræsenteret på vejen til at simulere en komplet encellet organisme. "Vi har ikke noget mindre end en celle, som vi ville kalde levende, " sagde han. "Det er det mindste levende væsen, og vi vil gerne forstå det."
Med næste generations supercomputere, herunder OLCF's topmøde, klar til at komme online i 2018, forskergruppen Schulten grundlagt i 1989 forbereder sig på at tage den store udfordring med at simulere en celle.
Under ledelse af Tajkhorshid, holdet planlægger at simulere den første milliardatomcelle, herunder de grundlæggende komponenter en celle har brug for for at overleve og vokse. Forbedringer af NAMD og arbejde under OLCF's Center for Accelerated Application Readiness-program er med til at gøre Schultens og andres vision til virkelighed.
"Vi bliver ved med at bevæge os fremad, "Singharoy sagde." Vores udtømmende undersøgelse af en komplet organel i alle atomdetaljer har åbnet døren for en fuld celle i alle atomdetaljer. "
 Varme artikler
Varme artikler
-
 Letvægts metalskum blokerer blastwave, affald fra højeksplosive skudDette billede viser CMF-panelet efter testen. De sorte mærker er fragmenter fanget inde i panelet. Billedet viser, at der ikke er nogen revner eller fysisk bøjning - selv efter at stykkerne ramte med
Letvægts metalskum blokerer blastwave, affald fra højeksplosive skudDette billede viser CMF-panelet efter testen. De sorte mærker er fragmenter fanget inde i panelet. Billedet viser, at der ikke er nogen revner eller fysisk bøjning - selv efter at stykkerne ramte med -
 Fra nata de coco til computerskærme:Cellulose får en chance for at skinneKontrol af optisk retardering af den justerede cellulosefilm. Kredit:Osaka University Et hold ved Institute of Scientific and Industrial Research ved Osaka University har bestemt de optiske parame
Fra nata de coco til computerskærme:Cellulose får en chance for at skinneKontrol af optisk retardering af den justerede cellulosefilm. Kredit:Osaka University Et hold ved Institute of Scientific and Industrial Research ved Osaka University har bestemt de optiske parame -
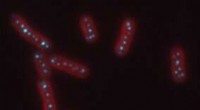 Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till
Forståelse af membranen i membranløse organellerPå billedet ses et fluorescensbillede af cyanobakterier, i rødt, med carboxysomer, i cyan. Kredit:Biteen og Vecchiarelli Labs Organeller i celler er små motorer, der indkapsler processer, der till -
 Video:Er vi ved at løbe tør for helium?Kredit:The American Chemical Society Vidste du, at ligesom visse dyr her på Jorden, der er truede elementer, også? For eksempel, vi mister konstant helium, en gas, der trodser tyngdekraften og und
Video:Er vi ved at løbe tør for helium?Kredit:The American Chemical Society Vidste du, at ligesom visse dyr her på Jorden, der er truede elementer, også? For eksempel, vi mister konstant helium, en gas, der trodser tyngdekraften og und
- Undersøgelse finder forbedringer af vandkvaliteten i Marylands Choptank River
- Hvorfor Australien stiger mod tendensen på mandlige fødsler
- Sci-fi hologrammer et skridt nærmere med en lille opfindelse
- En speciel elementær magi
- Hvordan Amerikas familiefjendtlige politikker skader kvinder og børn
- Gamle landbrugsteknikker kunne hjælpe med at afbøde klimaændringer


