Hvordan skriver du kemiske formler med oxidationsnumre?
Forståelse af oxidationsnumre
* Definition: Oxidationsnumre repræsenterer den hypotetiske ladning, som et atom ville have, hvis alle dens bindinger var 100% ioniske.
* regler: Der er specifikke regler for at bestemme oxidationsnumre. Her er de vigtigste:
* Elementær form: Oxidationsnummeret for et element i dets rene, ukombinerede tilstand er altid 0. (f.eks. O2, NA, CL2)
* Monatomiske ioner: Oxidationsnummeret for en monatomisk ion er lig med dens ladning. (f.eks. Na + =+1, cl- =-1)
* gruppe 1: Elementer i gruppe 1 (alkalimetaller) har et oxidationsnummer på +1.
* gruppe 2: Elementer i gruppe 2 (alkaliske jordmetaller) har et oxidationsnummer på +2.
* halogener: Halogener har normalt et oxidationsnummer på -1, undtagen når de kombineres med ilt eller en anden halogen.
* ilt: Oxygen har normalt et oxidationsnummer på -2, undtagen i peroxider (f.eks. H2O2, hvor det er -1).
* brint: Hydrogen har normalt et oxidationsnummer på +1, undtagen når de kombineres med metaller (f.eks. Nah, hvor det er -1).
* Summen af oxidationsnumre i en neutral forbindelse skal svare til 0.
* Summen af oxidationsnumre i en polyatomisk ion skal svare til ladningen af ionen.
Skrivning af kemiske formler
1. Identificer elementerne: Bestem de elementer, der er til stede i forbindelsen.
2. Bestem oxidationsnumrene: Brug de ovennævnte regler til at tildele oxidationsnumre til hvert element.
3. Balance anklagerne: Sørg for, at summen af oxidationsnumrene i forbindelsen er lig med nul. Juster underskrifterne af elementerne efter behov for at opnå denne balance.
Eksempler
* vand (H2O):
* H har et oxidationsnummer på +1.
* O har et oxidationsnummer på -2.
* For at balancere har vi brug for to hydrogenatomer (+1 hver) for hvert iltatom (-2).
* Formel:H₂O
* kuldioxid (CO2):
* O har et oxidationsnummer på -2.
* For at balancere skal kulstof have et oxidationsnummer på +4.
* Formel:CO₂
* jern (III) oxid (Fe2O3):
* Jern har et oxidationsnummer på +3 (angivet med det romerske tal III).
* Oxygen har et oxidationsnummer på -2.
* For at balancere har vi brug for to jernatomer (+3 hver) for hvert tre iltatomer (-2 hver).
* Formel:Fe₂o₃
* sulfation (so₄²⁻):
* Oxygen har et oxidationsnummer på -2.
* Ionens samlede ladning er -2.
* For at balancere skal svovl have et oxidationsnummer på +6.
* Formel:So₄²⁻
Vigtige noter:
* romerske tal: Romertal bruges til at indikere oxidationsnummeret for et metal, når det har flere mulige oxidationstilstande (f.eks. Jern (II) oxid, Feo; jern (III) oxid, Fe2O3).
* Praksis: Det er vigtigt at øve sig på at bestemme oxidationsnumre og skrive kemiske formler for at blive dygtige.
* Undtagelser: Mens de generelle regler for bestemmelse af oxidationsnumre er nyttige, er der altid undtagelser. Se en pålidelig kemisk lærebog eller ressource for mere dybdegående information.
Sidste artikelHvad er oxidationsantallet af kobber i iodid?
Næste artikelHvor er oxidationsnummeret skrevet?
 Varme artikler
Varme artikler
-
 Forskere anvender kemiske værktøjer til at opdage kræftfremkaldende proteinerYekaterina Kovalyova. Kredit:Yale University Forskere ved Yales Microbial Sciences Institute har taget et vigtigt skridt i vores forståelse af, hvordan infektion ændrer proteiner på en måde, der fr
Forskere anvender kemiske værktøjer til at opdage kræftfremkaldende proteinerYekaterina Kovalyova. Kredit:Yale University Forskere ved Yales Microbial Sciences Institute har taget et vigtigt skridt i vores forståelse af, hvordan infektion ændrer proteiner på en måde, der fr -
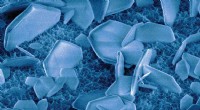 Vand spiller en uventet rolle i dannelsen af mineralerZinkoxidnanopartikler suspenderet i vand klikker sammen, når de er korrekt justeret og danner større krystaller (vist her). Kræfterne mellem partiklerne langs en specifik fastgørelsesretning blev målt
Vand spiller en uventet rolle i dannelsen af mineralerZinkoxidnanopartikler suspenderet i vand klikker sammen, når de er korrekt justeret og danner større krystaller (vist her). Kræfterne mellem partiklerne langs en specifik fastgørelsesretning blev målt -
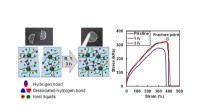 Fremtiden for elektroniske enheder:Stærke og selvhelbredende iongelerIongelen udviser hurtig selvhelbredende evne ved stuetemperatur ved at omdanne hydrogenbindinger på den beskadigede overflade. Brudspændingen af iongelen efter heling 3 timer er sammenlignelig med d
Fremtiden for elektroniske enheder:Stærke og selvhelbredende iongelerIongelen udviser hurtig selvhelbredende evne ved stuetemperatur ved at omdanne hydrogenbindinger på den beskadigede overflade. Brudspændingen af iongelen efter heling 3 timer er sammenlignelig med d -
 Søgemaskine til smart træEnzymet laccase er i stand til at ændre træets kemiske struktur på dets overflade og dermed lette biokemiske ændringer uden at ændre materialets struktur. Imidlertid, der er forskellige lakser - og de
Søgemaskine til smart træEnzymet laccase er i stand til at ændre træets kemiske struktur på dets overflade og dermed lette biokemiske ændringer uden at ændre materialets struktur. Imidlertid, der er forskellige lakser - og de
- En miljøvenlig teknik til at opgradere metalaffald til multifunktionelle aerogeler
- Hvad er et eksempel på en gas til fast deponering?
- Hvordan indstiller du tiden på et Casio 2608 GW-300 armbåndsur?
- Hvad er egenskaberne ved ikke-jernholdige metaller?
- Hvordan kan nitrogen bruges?
- Sådan løser du problemproblemer


