Hvad er oxidationsantallet af kobber i iodid?
* iodidion (i-) :Dette er et enkelt atom med en -1 ladning. Kobber findes ikke i en forbindelse med kun iodidioner.
* iodidforbindelse :Dette kan være enhver forbindelse, der indeholder jod, som kobber (I) iodid (Cui) eller kobber (II) iodid (Cui₂).
Lad os analysere de mulige scenarier:
1. Kobber i en forbindelse med iodidioner (i-)
Kobber kan ikke eksistere som en simpel kation (Cu+) i opløsning med iodidioner. Dette skyldes, at iodidionen er et stærkt reduktionsmiddel, og kobber (I) oxideres let til kobber (II) af iodid.
2. Kobber i kobber (i) iodid (CUI)
* jod (i): Vi ved, at jod er et halogen og har typisk et oxidationsnummer på -1.
* kobber (CU): Da der kun er et kobberatom og et jodatom, skal kobber have et oxidationsnummer på +1 for at afbalancere -1 -ladning af jod.
3. Kobber i kobber (II) iodid (CUI₂)
* jod (i): Igen har jod et oxidationsnummer på -1.
* kobber (CU): Med to iodatomer (total ladning på -2) skal kobber have et oxidationsnummer på +2 for at afbalancere ladningen.
Kortfattet:
* Kobber findes ikke i en forbindelse med kun iodidioner.
* Oxidationsantallet af kobber i kobber (I) iodid er +1.
* Oxidationsantallet af kobber i kobber (II) iodid er +2.
Sidste artikelHvad er oxidationsnumrene i chromiiii -oxid?
Næste artikelHvordan skriver du kemiske formler med oxidationsnumre?
 Varme artikler
Varme artikler
-
 Energihøstende plastik består syretestenDiego Rosas-Villalva forklarede, at holdet var overrasket over, at en så ekstremt tynd polymer var så effektiv til at forbedre enhedens levetid. Kredit:KAUST En polymer, der tidligere blev brugt t
Energihøstende plastik består syretestenDiego Rosas-Villalva forklarede, at holdet var overrasket over, at en så ekstremt tynd polymer var så effektiv til at forbedre enhedens levetid. Kredit:KAUST En polymer, der tidligere blev brugt t -
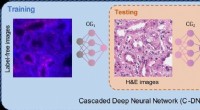 Kemikaliefri genfarvning af væv ved hjælp af dyb læringVirtuel genfarvning af væv ved hjælp af kaskadede dybe neurale netværk. Kredit:Ozcan Lab @ UCLA. Vævsbaseret diagnosticering af sygdomme er afhængig af den visuelle inspektion af biopsierede vævspr
Kemikaliefri genfarvning af væv ved hjælp af dyb læringVirtuel genfarvning af væv ved hjælp af kaskadede dybe neurale netværk. Kredit:Ozcan Lab @ UCLA. Vævsbaseret diagnosticering af sygdomme er afhængig af den visuelle inspektion af biopsierede vævspr -
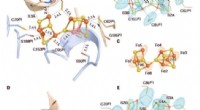 Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A
Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenaseDe oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A -
 Ingeniører opdager en ny rolle for vand i produktionen af vedvarende brændstofferOU-ingeniører har opdaget en ny tilgang til vandstøttet opgradering af det vedvarende kemikalie, furfural, fordoble eller tredoble konverteringshastigheden. Kredit:University of Oklahoma Universit
Ingeniører opdager en ny rolle for vand i produktionen af vedvarende brændstofferOU-ingeniører har opdaget en ny tilgang til vandstøttet opgradering af det vedvarende kemikalie, furfural, fordoble eller tredoble konverteringshastigheden. Kredit:University of Oklahoma Universit
- Design af sociale medier, der søger at afbøde polarisering, kan øge den ideologiske afstand
- Video:Hvad skal der til for at forvandle Boston havn til te?
- Er radioaktivt en metallisk sølv sort rock, der smelter is ret hurtigt?
- Den mindste biosuperkondensator giver energi til biomedicinske applikationer
- Hvorfor tog det så lang tid at opdage Planet Nine?
- Sådan løser du problemer med identitetstyveri forårsaget af Equifax-hacket


