Strukturelt bevis for en dynamisk metallocofaktor under dinitrogenreduktion ved Mo-nitrogenase
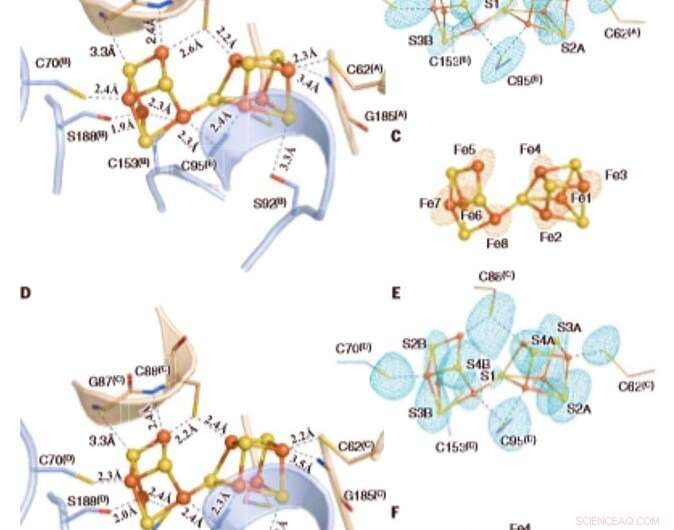
De oxiderede P-klynger i Av1*. Strukturer af P-klynger ved (A til C) grænsefladen mellem kæder A og B [P-klynge (A/B)] og (D til F) grænsefladen mellem kæder C og D [P-klynge (C/D) ] af Av1*. Kæder A og C er a-underenhederne, og kæderne B og D er b -underenhederne i de to ab -dimerer i Av1*. [(A) og (D)] P-klyngerne vises i kugle-og-stav-præsentation, og nøgleresterne, der interagerer med P-klyngerne, er angivet som pinde. Kæder A og C er vist som hvedebånd, og kæderne B og D er vist som lyseblå bånd. [(B) og (C)] P-klynge (A/B) og [(E) og (F)] P-klynge (C/D) overlejret med [(B) og (E)] de anomale densitetskort beregnet til 7100 eV ved en opløsning på 2,18 Å og kontureret ved 4,0s, viser positionen af svovlatomer (mynteblåt net); og med [(C) og (F)] de anomale densitetskort beregnet til 7141 eV ved en opløsning på 2,1 Å og kontureret ved 15,0s, viser positionen af jernatomer (rød maske). Atomer er farvet som følger:Fe, orange; S, gul; O, rød; N, blå. Enkeltbogstavs forkortelser for aminosyreresterne er som følger:C, Cys; G, Gly; H, Hans; R, Arg; S, Ser. Kredit:Videnskab, doi:10.1126/science.aaz6748
Enzymet nitrogenase er en biologisk katalysator, der kan reducere dinitrogen (N2) til ammoniak i nærvær af en række komplekse metallokofaktorer. Imidlertid, de mekanistiske detaljer i reaktionen er stadig knappe. I en ny rapport om Videnskab , Wonchull Kang og et forskerhold i kemi, molekylærbiologi og biokemi ved University of California-Irvine, OS., rapporterede en 1,83-Ångstrøm krystalstruktur for nitrogenase molybdæn-jern (MoFe) protein, som de fangede under fysiologiske omsætningsbetingelser for dinitrogen. Resultaterne af undersøgelsen kan vurdere de mulige mekanismer for N 2 reduktion og bælte-svovlpladsers rolle under processen.
Nitrogenase er en katalysator for et kritisk trin i den globale nitrogencyklus, under den omgivende reduktion af atmosfærisk dinitrogen (N 2 ) til den biotilgængelige ammoniak (NH 3 ). Molybdænnitrogenaseenzymet indeholder to proteinkomponenter:den ene indeholder jern (Fe) -proteinet i et jernsvovl (Fe 4 S 4 ) klynge med et adenosintrifosfat (ATP) -bindende sted inden for hver underenhed. Den anden, molybdænjern (MoFe) protein, der indeholder et a 2 β 2 heterotetramer med to komplekse metalloclusters. Under molybdæn-nitrogenase (Mo-nitrogenase) katalyse, den gentagne association og dissociation mellem de to proteinkomponenter tillod ATP-afhængig elektronoverførsel fra Fe 4 S 4 klynge til MoFe -proteinet til substratreduktion. Nitrogenas evne til at transportere mange elektroner til dens kofaktor gjorde enzymet meget alsidigt under substratreduktion.
Forståelse af virkningsmekanismen for nitrogenaseenzymet
Mange bestræbelser er gået for at forstå mekanismerne for nitrogenase siden dets opdagelse, hvor nogle havde fokuseret på enzymets substrat- og inhibitorinteraktioner. Af disse bestræbelser, Kang et al. fastlagt en strategi, der er værd at overveje ved at begrænse overskydende elektronforsyninger, der utilsigtet drev N 2 reduktion fremad. Dette vendte enzymets substrat eller mellemliggende tilstand til en hviletilstand eller reducerede enzymet til en usynlig blandet tilstand. Processen var relevant, da nitrogenaseproteiner rutinemæssigt isoleres i nærvær af overskydende dithionit som et eksternt leveret reduktant, og fjernelse af denne kunstige elektronkilde i fravær af ilt kunne hjælpe forskere med at fange dinitrogen (N 2 ) eller dets mellemprodukter til analyse.
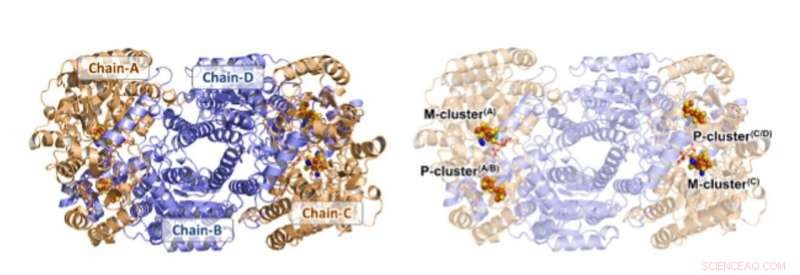
Struktur af Av1*. Solid (venstre) og gennemsigtig (højre) båndpræsentation af heterotetrameren i Av1*, med a-underenhederne (kæde-A og kæde-C) og b-underenheder (kæde-B og kæde-D) farvet i hvede og blå, henholdsvis. M- og P-klyngerne er illustreret som rumfyldningsmodeller. Atomers farvekode:Fe, orange; S, gul; O, rød; N, blå; Mo, cyan; C, grå. M-klyngerne i kæde-A og kæde-C betegnes M-klynge (A) og M-klynge (C), henholdsvis. P-klyngerne ved kæde-A/kæde-B og kæde-C/kæde-D grænseflader betegnes P-klynge (A/B) og P-klynge (C/D), henholdsvis. PYMOL blev brugt til at forberede dette tal. Kredit:Videnskab, doi:10.1126/science.aaz6748
Som et bevis på konceptet, Kang et al. fremstillede råekstraktet af en anerob bakteriestamme Azotobacter vinelandii med eller uden tilsætning af dithionit efter celleforstyrrelse. A. vinelandii-stammen udtrykte aktivt en Mo-nitrogenase indeholdende et histidin-mærket MoFe-protein i begge tilfælde. Da de analyserede aktiviteten af disse prøver, de dithionitfrie råekstraktprøver var næsten inaktive under substratreduktion-på grund af udtømning af elektroner i råekstrakterne under celleforstyrrelser. Kang et al. kunne derfor fuldstændigt genoprette aktiviteten af prøver ved at tilføje dithionit og ATP (dvs. ved at levere elektroner).
Klynger af nitrogenase-to unikke metalloklynger:P-klyngen og M-klyngen.
Baseret på de skitserede betingelser, når en nitrogenase-udtrykkende kultur, der aktivt udfører N 2 fiksering udsættes for cellelyse uden yderligere elektronforsyninger, nitrogenasen forblev funktionel. Selvom det potentielt blev anholdt i en "sovende" eller mellemliggende tilstand på grund af tilbagetrækning af elektronstrøm til et jern-svovlmetallokluster kendt som M-klyngen, lokaliseret i nitrogenaseenzymet. Da Kang et al. rensede det dithionitfrie råekstrakt, det histidin-mærkede MoFe-protein (betegnet AV1* i undersøgelsen) var aktivt under N 2 reduktion og også fuldt funktionel. Da teamet krystalliserede AV1*, de observerede brune krystaller, der diffrakterede til en opløsning på 1,83 Ångstrøm (Å). De bekræftede den strukturelle omlægning af de to P-klynger af AV1* ved hjælp af anomaliske densitetsdata og brugte elektronparamagnetisk resonans til at observere den strukturelle tildeling. Resultaterne gav dem længe søgt svar på den fysiologiske relevans af denne eksperimentelle tilstand og pegede på en begrænset strøm af elektroner mellem de to unikke metalloklynger (P- og M-klynger) af forbindelsen i fravær af dithionit.
En sandsynlig mekanisme for N2-reduktion ved Mo-nitrogenase. Kredit:Markus Ribbe og Yilin Hu, Videnskab , doi:10.1126/science.aaz6748 
En sandsynlig virkningsmekanisme, der stemte overens med de eksperimentelle observationer, omfattede den trinvise reduktion af dinitrogen (N 2 ) på de tre bælte svovlsteder på nitrogenasekatalysatoren baseret på rotation af M-klyngen. Den foreslåede mekanisme begynder med tæt binding af N 2 på et bestemt sted, efterfulgt af rotation af det bundne N 2 til et andet efterfølgende sted (steder betegnet S3A til S2B til S5A på forbindelsen). Under processen, reduktionen/protonationen af N 2 til diazenniveauet skete gennem hydrogenbinding, efterfulgt af yderligere reduktion/protonering for dens omdannelse til ammoniak, før det frigøres fra strukturen. Efterfølgende rotation af klyngen bragte et nyt N 2 molekyle til det næste sted for at starte den næste runde med trinvis N 2 reduktion gennem fortsat klyngrotation i en delikat mekanisme under katalyse. Sådan cykling mellem forskellige reaktionssteder var løst analog med mekanismen for ATP -syntaseenzymet. Den roterende metallocluster gav således effektivt mulighed for multi-elektronreduktionen af N 2 gennem en opdeling-og-erobre tilgang.
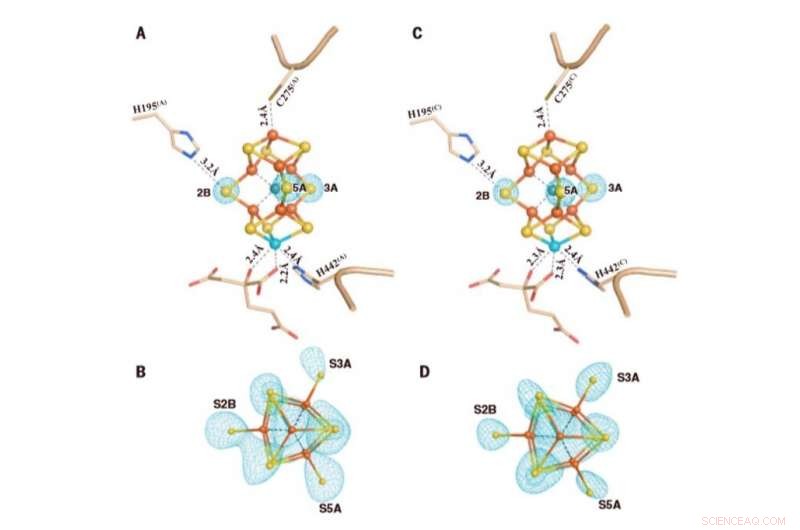
M-klyngerne i Av1*(TOD). Strukturer af M-klynger i (A og B) kæde A [M-klynge (A)] og (C og D) kæde C [M-klynge (C)] raffineret med en opløsning på 1,73 Å. Side view of (A) M-cluster(A) and (C) M-cluster(C) with key residues interacting with the clusters indicated as sticks. M-cluster(A) and M-cluster(C) are superimposed with the Fo-Fc omit maps of the belt sulfurs contoured at 13s (mint-blue mesh). View along the Fe1-C-Mo direction of (B) M-cluster(A) and (D) M-cluster(C) superimposed with the anomalous density maps calculated at 7100 eV at a resolution of 2.17 Å and contoured at 4.0s, showing the presence of the anomalous sulfur density (mint-blue mesh) at all belt sulfur positions (S2B, S3A, and S5A) in (B) M-cluster(A) and (D) M-cluster(C). Credit:Science, doi:10.1126/science.aaz6748
To understand the sulfur-displaced conformation of AV1* under limited electron flux, the team formed AV1* turnover with dithionite (designated as AV1*TOD), to yield brown crystals that diffracted to a resolution of 1.73 Å. The observations were consistent with the mechanism of bound dinitrogen species on the compound and illustrated the physiological relevance of the conformation during catalysis. The capacity to displace three different sites by a dinitrogen species was consistent with previous investigations on catalysis-dependent selenium. Kang et al. proposed many mechanisms to explain the observations, however they seek further experimental support to verify them. The team highlighted the possibility for all belt-sulfur sites to be involved in the process of catalysis due to the presence of asymmetric belt-sulfur displacements in the compound. The results aim to provoke a paradigm shift in the mechanistic thinking of nitrogenase activity, ultimately to understand the intricate mechanism of the enzyme.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Forskere udvikler nye metoder til at studere materialer i mindst mulig skalaKredit: Videnskabens fremskridt Forskere over hele verden er interesserede i at udvikle nye materialer til at hjælpe mennesker med at leve mere bæredygtige og sunde liv, men stræben efter at prod
Forskere udvikler nye metoder til at studere materialer i mindst mulig skalaKredit: Videnskabens fremskridt Forskere over hele verden er interesserede i at udvikle nye materialer til at hjælpe mennesker med at leve mere bæredygtige og sunde liv, men stræben efter at prod -
 Nyt materiale til behandling af sår kan beskytte mod resistente bakterierForskere ved Chalmers Tekniske Universitet, Sverige, har udviklet et nyt materiale, der dræber bakterier og potentielt kan forhindre infektioner i sår - en specialdesignet hydrogel, der virker mod all
Nyt materiale til behandling af sår kan beskytte mod resistente bakterierForskere ved Chalmers Tekniske Universitet, Sverige, har udviklet et nyt materiale, der dræber bakterier og potentielt kan forhindre infektioner i sår - en specialdesignet hydrogel, der virker mod all -
 Videnskabelige eksperimenter på osmose af en kartoffelOsmose, processen, hvor opløsningsmiddelmolekyler bevæger sig fra et område med lavere opløst koncentration til et område med højere opløst koncentration, kan let demonstreres med kartoffeleksperiment
Videnskabelige eksperimenter på osmose af en kartoffelOsmose, processen, hvor opløsningsmiddelmolekyler bevæger sig fra et område med lavere opløst koncentration til et område med højere opløst koncentration, kan let demonstreres med kartoffeleksperiment -
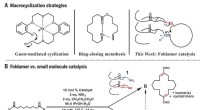 Efterligner enzymer, kemikere producerer store, nyttige carbonringeMakrocykliseringsstrategier. (A) Tidligere tilgange og foldamertilgang til makrocyklisering. (B) Divergent reaktivitet:Foldamer versus små molekyle katalyse. lign., ækvivalent(er). Kredit: Videnskab
Efterligner enzymer, kemikere producerer store, nyttige carbonringeMakrocykliseringsstrategier. (A) Tidligere tilgange og foldamertilgang til makrocyklisering. (B) Divergent reaktivitet:Foldamer versus små molekyle katalyse. lign., ækvivalent(er). Kredit: Videnskab
- Uorganiske og organiske komponenter i jord
- Blandede skove:Økologisk og økonomisk overlegne
- Neandertaler og tidlig moderne menneskelig stenværktøjskultur eksisterede side om side i over 100,…
- Sådan konverteres et decimal til timer og minutter
- Sådan fremstilles et simpelt hydraulisk system
- Klimatiltag kan begrænse Asiens voksende vandmangel


