Hvad er obligationsordren for N2O?
1. Tegn Lewis -strukturen:
* tæller valenselektroner: N (5 valenselektroner) x 2 + O (6 valenselektroner) =16 valenselektroner.
* Centralatom: Nitrogen er mindre elektronegativ end ilt, så det er det centrale atom.
* Opret forbindelse med enkelt obligationer: N-n-o
* Komplet octets: Strukturen vil se sådan ud:
* N =n =O (med et ensomt par på hver terminal N og O)
2. Beregn formelle afgifter:
* formel ladning =(valenselektroner) - (ikke -bindende elektroner) - (1/2 bindingselektroner)
* til venstre n: 5 - 2 - (1/2) 4 =0
* for det centrale n: 5 - 0 - (1/2) 8 =+1
* for O: 6 - 4 - (1/2) 4 =0
3. Resonansstrukturer:
Der er to resonansstrukturer for N₂O:
* struktur 1: N =n =o
* struktur 2: N - n ≡ o
4. Bestem obligationsordrer:
* obligationsordre =(antal bindinger mellem to atomer) / (antal resonansstrukturer)
* n-n Bond:
* Struktur 1:Dobbeltbinding (2)
* Struktur 2:Enkelt obligation (1)
* Gennemsnitlig obligationsordre =(2 + 1) / 2 = 1,5
* n-o-obligation:
* Struktur 1:Dobbeltbinding (2)
* Struktur 2:Triple Bond (3)
* Gennemsnitlig obligationsordre =(2 + 3) / 2 = 2.5
Derfor er obligationsordren for N-N-obligationen i N₂O 1,5, og obligationsordren for N-O-obligationen er 2,5.
 Varme artikler
Varme artikler
-
 Nanopartikler har brug for lidt plads til at overføre energiForskere viser, hvordan energi bevæger sig (grøn) eller ikke (rød) langs nanopartikelkæder. Kredit:Journal of Materials Chemistry C. Royal Society of Chemistry Hurtig overførsel af energi fra et s
Nanopartikler har brug for lidt plads til at overføre energiForskere viser, hvordan energi bevæger sig (grøn) eller ikke (rød) langs nanopartikelkæder. Kredit:Journal of Materials Chemistry C. Royal Society of Chemistry Hurtig overførsel af energi fra et s -
 Trykpåvirkning er ikke skyld i tilsmudsning af membraner, undersøgelse finderEmily Tow PhD 17, viser udstyr, hun har udviklet til at måle virkningerne af forskellige trykniveauer på den måde, mikroorganismer opbygges på membraner, der bruges til afsaltning af vand. Kredit:Mass
Trykpåvirkning er ikke skyld i tilsmudsning af membraner, undersøgelse finderEmily Tow PhD 17, viser udstyr, hun har udviklet til at måle virkningerne af forskellige trykniveauer på den måde, mikroorganismer opbygges på membraner, der bruges til afsaltning af vand. Kredit:Mass -
 Fluorescerende molekyler afsløret af kvantekemi og maskinlæringOtte forbindelser blev forudsagt at fluorescere ved en ny metode til design af molekyler. Af de otte blev seks fundet at fluorescere under ultraviolet lys (fem vist; C, D, E, F, G), inklusive en forbi
Fluorescerende molekyler afsløret af kvantekemi og maskinlæringOtte forbindelser blev forudsagt at fluorescere ved en ny metode til design af molekyler. Af de otte blev seks fundet at fluorescere under ultraviolet lys (fem vist; C, D, E, F, G), inklusive en forbi -
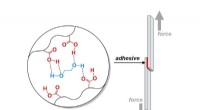 Hvordan laver man klæbemidler til elektronik, køretøjer, og konstruktion hårdere?Et Purdue University-team tilføjede bindinger, der let brydes i hele materialet for at styrke klæbemidlet. Kredit:Jonathan Wilker/Purdue University Gør dem hårdere ved at gøre dem svagere. Det er
Hvordan laver man klæbemidler til elektronik, køretøjer, og konstruktion hårdere?Et Purdue University-team tilføjede bindinger, der let brydes i hele materialet for at styrke klæbemidlet. Kredit:Jonathan Wilker/Purdue University Gør dem hårdere ved at gøre dem svagere. Det er
- Hvorfor bevæger faldende genstande sig hurtigere end at gå opad?
- Kan vi bringe neandertalerne tilbage?
- Sådan måles kulstofniveauer
- Guld nanopartikler viser løfte om tidlig opdagelse af hjerteanfald
- The Very Large Array:Astronomisk shapeshifter
- Hvordan er en ionisk binding mellem to malm flere atomer?


