Hvad er der oxidationsnummer for nitrogen?
Generelle regler:
* gratis element: Oxidationsnummeret for et element i sin elementære form er altid 0. Så, N₂ (nitrogengas) har et oxidationsnummer på 0.
* Monatomiske ioner: Oxidationsnummeret for en monatomisk ion er lig med dens ladning. For eksempel har N³⁻ (nitridion) et oxidationsnummer på -3.
* ilt: Oxygen har normalt et oxidationsnummer på -2, undtagen i peroxider (som H₂O₂), hvor det er -1.
* brint: Brint har normalt et oxidationsnummer på +1, undtagen i metalhydrider (som NAH), hvor det er -1.
* summen af oxidationsnumre: Summen af oxidationsnumrene i en neutral forbindelse skal svare til nul, og i en polyatomisk ion skal den svare til ladningen af ionen.
Eksempler:
* nh₃ (ammoniak): H er +1, så 3 timers atomer bidrager +3. For at balancere skal n være -3.
* hno₃ (salpetersyre): O er -2, så 3 O -atomer bidrager -6. H er +1. For at balancere skal N være +5.
* n₂o (nitrogenoxid): O er -2. For at balancere skal hver n være +1.
* no₂ (nitrogendioxid): O er -2, så 2 O -atomer bidrager -4. For at balancere skal N være +4.
Vigtige noter:
* Oxidationsnumre tildeles, ikke måles: De er en måde at holde styr på elektronoverførsel i reaktioner.
* Oxidationsnummeret kan være fraktioneret: I nogle tilfælde, som i N₂O, er oxidationsnummeret for nitrogen ikke et helt tal.
Fortæl mig, hvis du har et specifikt nitrogenholdigt molekyle i tankerne, og jeg kan hjælpe dig med at bestemme dets oxidationsnummer.
Sidste artikelHvad er hovedfunktionen i periodisk tabel?
Næste artikelHvad er de typer kovalente bindinger i kemi?
 Varme artikler
Varme artikler
-
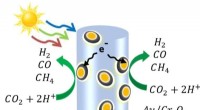 Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede hull
Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede hull -
 Filter kan være et match til fracking af vandEt superhydrofilt filter produceret på Rice University kan fjerne mere end 90 procent af forurenende stoffer fra vand, der bruges i hydrauliske fraktureringsoperationer. På dette billede, produceret v
Filter kan være et match til fracking af vandEt superhydrofilt filter produceret på Rice University kan fjerne mere end 90 procent af forurenende stoffer fra vand, der bruges i hydrauliske fraktureringsoperationer. På dette billede, produceret v -
 Kobberoxidfotokatoder:Lasereksperiment afslører placeringen af effektivitetstabEn grøn laserimpuls exciterer indledningsvis elektronerne i Cu2O; kun brøkdele af et sekund senere, en anden laserimpuls (UV-lys) sonderer energien af den exciterede elektron. Kredit:M. Kuensting/HZ
Kobberoxidfotokatoder:Lasereksperiment afslører placeringen af effektivitetstabEn grøn laserimpuls exciterer indledningsvis elektronerne i Cu2O; kun brøkdele af et sekund senere, en anden laserimpuls (UV-lys) sonderer energien af den exciterede elektron. Kredit:M. Kuensting/HZ -
 Ny kemisk proces et første skridt til fremstilling af nukleart brændsel med ildForbrændingssyntese af LnBTA-forbindelse. Kredit:Los Alamos National Laboratory Udvikling af sikre og bæredygtige brændstoffer til atomenergi er en integreret del af Los Alamos National Laboratory
Ny kemisk proces et første skridt til fremstilling af nukleart brændsel med ildForbrændingssyntese af LnBTA-forbindelse. Kredit:Los Alamos National Laboratory Udvikling af sikre og bæredygtige brændstoffer til atomenergi er en integreret del af Los Alamos National Laboratory
- Fra spejlbilledbiologi til forbedrede terapeutiske proteiner
- At undgå klimasammenbrud afhænger af at beskytte jordens biodiversitet – kan COP15-topmødet lever…
- Spanien tildelte 1,6 mia. Euro over Prestige -olieudslip
- Forskere ser på tidligere databehandlinger for at låse op for 3-D-printede mekaniske logiske porte…
- Hvor mange mol SO3 ville blive produceret, når der forbruges 1,2 ilt i ligningen S plus O2 er lig m…
- Lockdown:Forbrydelser i hjemmet er stigende - nye foranstaltninger er nødvendige for at advare mynd…


