Hvad er de typer kovalente bindinger i kemi?
1. Enkelt kovalent binding:
* Involverer deling af et par af elektroner mellem to atomer.
* Repræsenteret af en enkelt linje (-) mellem de bundne atomer.
* Eksempel:H-H (brintmolekyle)
2. Dobbelt kovalent binding:
* Involverer deling af to par af elektroner mellem to atomer.
* Repræsenteret af en dobbelt linje (=) mellem de bundne atomer.
* Eksempel:O =O (iltmolekyle)
3. Triple Covalent Bond:
* Involverer deling af tre par af elektroner mellem to atomer.
* Repræsenteret af en tredobbelt linje (≡) mellem de bundne atomer.
* Eksempel:n≡n (nitrogenmolekyle)
4. Koordinat kovalent binding (dativ obligation):
* Et atom giver begge Elektroner til det delte par.
* Atomet, der leverer elektronerne, kaldes donor , og atomet, der modtager dem, er acceptor .
* Repræsenteret af en pil, der peger fra donoren til acceptoren.
* Eksempel:I ammoniumion (NH4+) tilvejebringer nitrogenatomet begge elektroner til at danne bindingen med hydrogenatomet.
5. Polar kovalent binding:
* Opstår, når de delte elektroner er ulige fordelt mellem de to atomer.
* Dette sker, når de to atomer har forskellige elektronegativitetsværdier.
* Atomet med den højere elektronegativitet vil tiltrække de delte elektroner stærkere, hvilket resulterer i en delvis negativ ladning på dette atom og en delvis positiv ladning på det andet atom.
* Eksempel:I vand (H2O) er iltatomet mere elektronegativt end hydrogenatomerne, hvilket fører til en polær kovalent binding.
6. Ikke-polær kovalent binding:
* Opstår, når de delte elektroner er lige fordelt mellem de to atomer.
* Dette sker, når de to atomer har lignende elektronegativitetsværdier.
* Eksempel:I klorgas (CL2) har begge kloratomer den samme elektronegativitet, hvilket fører til en ikke-polær kovalent binding.
7. Sigma (σ) Bond:
* stærkeste type kovalent binding.
* Opstår, når det delte elektronpar er placeret direkte mellem De to bundne atomer.
* Hver enkelt obligation er en Sigma -obligation.
* Dobbelt- og tredobbelt obligationer indeholder henholdsvis en Sigma -obligation og en eller to PI -obligationer.
8. PI (π) Bond:
* Dannet, når det delte elektronpar er placeret over og under Linjen, der slutter sig til de to bundne atomer.
* Svagere end Sigma -obligationer.
* Fundet kun i dobbelt- og tredobbelt obligationer.
Dette er de vigtigste typer af kovalente bindinger. Den specifikke type kovalent binding afhænger af de involverede elementer og deres elektroniske konfiguration. At forstå disse forskellige typer er afgørende for at forstå strukturen, egenskaberne og reaktionerne af molekyler.
Sidste artikelHvad er der oxidationsnummer for nitrogen?
Næste artikelEr zink en fed opløselig eller vandopløselig?
 Varme artikler
Varme artikler
-
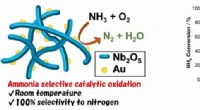 Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit
Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit -
 Elektrokemisk reaktion driver nye lægemiddelfundKredit:CC0 Public Domain Et Cornell-ledet samarbejde vender omskifteren til traditionel syntetisk kemi ved at bruge elektricitet til at drive en ny kemisk reaktion, der tidligere stubbe kemikere,
Elektrokemisk reaktion driver nye lægemiddelfundKredit:CC0 Public Domain Et Cornell-ledet samarbejde vender omskifteren til traditionel syntetisk kemi ved at bruge elektricitet til at drive en ny kemisk reaktion, der tidligere stubbe kemikere, -
 Billig tin pakker et stort slag for fremtiden for superkapacitorerForskere dopede koboltoxid med tin for at skabe en mere effektiv elektrode til brug i superkapacitorer. Dette mikroskopiske billede viser det nye materiale på grafenfilm. Kredit:JIa Zhu/Penn State
Billig tin pakker et stort slag for fremtiden for superkapacitorerForskere dopede koboltoxid med tin for at skabe en mere effektiv elektrode til brug i superkapacitorer. Dette mikroskopiske billede viser det nye materiale på grafenfilm. Kredit:JIa Zhu/Penn State -
 Tredimensionelle Mn-doterede nanoplader som effektive elektrokatalysatorer til alkalisk vandspaltnin…Mn-dopet Ni2 O3 /Ni2 P og Mn-dopet NixSy/Ni2 P fremstilles med succes gennem hydrotermisk reaktion og efterfølgende phosphorisering og svovldannelse. Karakteriseringsresultaterne viser også, at eksist
Tredimensionelle Mn-doterede nanoplader som effektive elektrokatalysatorer til alkalisk vandspaltnin…Mn-dopet Ni2 O3 /Ni2 P og Mn-dopet NixSy/Ni2 P fremstilles med succes gennem hydrotermisk reaktion og efterfølgende phosphorisering og svovldannelse. Karakteriseringsresultaterne viser også, at eksist
- Suontakas våbengrav, Hattula i Finland afslører fleksible kønsroller i den tidlige middelalder
- Ny teknologi kan revolutionere 3-D-print
- Er fysisk egenskabsevne til at overføre varme eller elektricitet let?
- Kvanteffekter observeret ved fotosyntese
- Hvordan har tyngdekraft og fusion modsatte effekter på en stjerne?
- Hvilken stor jovisk måne menes at være blevet fanget i sin nuværende bane?


