Er H2O en syre eller en base, når den har vand i det?
Her er hvordan:
* som syre: Vand kan donere en proton (H⁺) til en base, hvilket efterlader en hydroxidion (OH⁻). For eksempel, når vand reagerer med ammoniak (NH₃), fungerer det som en syre:
`` `
H₂O + NH₃ ⇌ NH₄⁺ + OH⁻
`` `
* som base: Vand kan acceptere en proton (H⁺) fra en syre, der danner en hydroniumion (H₃O⁺). For eksempel, når vand reagerer med saltsyre (HCI), fungerer det som en base:
`` `
H₂O + HCL ⇌ H₃O⁺ + CL⁻
`` `
Så vand er ikke strengt en syre eller en base; Dets opførsel afhænger af det andet stof, det interagerer med.
Sidste artikelKobberatomer holdes sammen af hvilken slags bindinger?
Næste artikelHvorfor er kogepunktet for vand højere end argon?
 Varme artikler
Varme artikler
-
 Konstrueret mikrobe kan være nøglen til at producere plastik fra planterUniversity of Wisconsin-Madison postdoc-forsker Alex Linz undersøger en tallerken strøget med N. aromaticivorans (i gult), en jordbakterie, der kunne gøre en vedvarende kilde-lignin fra planteceller
Konstrueret mikrobe kan være nøglen til at producere plastik fra planterUniversity of Wisconsin-Madison postdoc-forsker Alex Linz undersøger en tallerken strøget med N. aromaticivorans (i gult), en jordbakterie, der kunne gøre en vedvarende kilde-lignin fra planteceller -
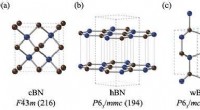 Forudsigelse af den mest stabile bornitridstruktur med kvantesimuleringerStrukturerne og rumgrupperne af (a) zink-blende bornitrid (cBN), (b) hexagonal bornitrid (hBN), (c) wurtzite bornitrid (wBN) og (d) romboedral bornitrid (rBN). Bor- og nitrogenatomer er afbildet i hen
Forudsigelse af den mest stabile bornitridstruktur med kvantesimuleringerStrukturerne og rumgrupperne af (a) zink-blende bornitrid (cBN), (b) hexagonal bornitrid (hBN), (c) wurtzite bornitrid (wBN) og (d) romboedral bornitrid (rBN). Bor- og nitrogenatomer er afbildet i hen -
 Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit
Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit -
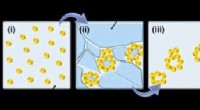 Multi-skala strukturerede materialer til elektrokatalyse og fotoelektrokatalyseSkematisk præsentation af fryse-tø-metoden. Kredit:Wiley-VCH Som en ny klasse af porøse materialer, noble metal aerogels (NMAer) har tiltrukket opmærksomhed for deres selvbærende arkitekturer, høj
Multi-skala strukturerede materialer til elektrokatalyse og fotoelektrokatalyseSkematisk præsentation af fryse-tø-metoden. Kredit:Wiley-VCH Som en ny klasse af porøse materialer, noble metal aerogels (NMAer) har tiltrukket opmærksomhed for deres selvbærende arkitekturer, høj


