Hvad sker der med partiklen i jern- og svovlreaktion?
1. Startmaterialer:
* jern (Fe): Jern findes som individuelle jernatomer med en metallisk bindingsstruktur.
* svovl (r): Svovl findes som molekyler af 8 svovlatomer bundet sammen (S8) i en ringlignende struktur.
2. Reaktionen:
* varme påføres: Dette giver den energi, der er nødvendig for at bryde bindingerne i svovlmolekylerne og svække de metalliske bindinger i jern.
* jernatomer kombineres med svovlatomer: Jernatomer mister elektroner (bliver positivt ladede ioner), mens svovlatomer får elektroner (bliver negativt ladede ioner).
* ioniske obligationer form: Det modsatte ladede jern- og svovlioner tiltrækker hinanden stærkt og danner en ionisk forbindelse kaldet jernsulfid (FES) .
3. Resultatet:
* Ny forbindelse: Reaktionen danner en ny forbindelse, jernsulfid med en anden kemisk sammensætning og egenskaber end enten jern eller svovl.
* Ændring i tilstand: Det faste jern og svovl kombineres for at danne et fast jernsulfid.
* eksotermisk reaktion: Reaktionen frigiver varme, hvilket indikerer, at bindingerne i jernsulfid er stærkere end dem i reaktanterne.
Visualisering af partikelændringerne:
* jern: Forestil dig en flok jernatomer, hver med en "sky" af løst holdt elektroner omkring det.
* svovl: Forestil dig en flok svovlringe, hver med 8 svovlatomer tilsluttet.
* reaktion: Varme får svovlringene til at gå i stykker, og jernatomerne mister elektroner. De negativt ladede svovlioner og positivt ladede jernioner går sammen for at danne en gitterstruktur af jernsulfid.
Nøglepunkter:
* Reaktionen er en kemisk ændring, hvilket betyder, at partiklerne er blevet omarrangeret for at danne et nyt stof.
* Reaktionen involverer overførsel af elektroner og danner ioniske bindinger.
* Reaktionen er eksotermisk og frigiver energi.
Sidste artikelHvad er produkterne fra mælkesyrefrementering?
Næste artikelHvad er forskellen mellem en neutronelektronproton og kerne?
 Varme artikler
Varme artikler
-
 Klimaændringer kan føre til et dramatisk temperaturafhængigt fald i essentielle omega-3-fedtsyrerMIT-WHOI Joint Program-studerende Henry Holm pumper havvand til lipidprøver fra under havis på den vestlige antarktiske halvø, 2018. Dette er til en WHOI-ledet undersøgelse, der gennemførte en global
Klimaændringer kan føre til et dramatisk temperaturafhængigt fald i essentielle omega-3-fedtsyrerMIT-WHOI Joint Program-studerende Henry Holm pumper havvand til lipidprøver fra under havis på den vestlige antarktiske halvø, 2018. Dette er til en WHOI-ledet undersøgelse, der gennemførte en global -
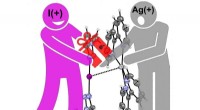 Interaktion mellem iodonium og sølvkation demonstreret for første gangSådan sker det:Positivt jod giver en elektrongave til positivt sølv. Kredit:Antonio Frontera og Kari Rissanen Et internationalt forskerhold ledet af professor Kari Rissanen fra University of Jyvas
Interaktion mellem iodonium og sølvkation demonstreret for første gangSådan sker det:Positivt jod giver en elektrongave til positivt sølv. Kredit:Antonio Frontera og Kari Rissanen Et internationalt forskerhold ledet af professor Kari Rissanen fra University of Jyvas -
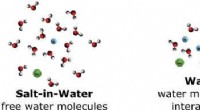 Højkoncentrerede vandige elektrolytter kunne erstatte opløsningsmidler, der bruges i batterierGrafisk abstrakt. Kredit: Aktuel mening i elektrokemi https://doi.org/10.1016/j.coelec.2020.01.006 Højkoncentrerede vandige elektrolytter, kendt som vand-i-salt elektrolytter, kunne være et alter
Højkoncentrerede vandige elektrolytter kunne erstatte opløsningsmidler, der bruges i batterierGrafisk abstrakt. Kredit: Aktuel mening i elektrokemi https://doi.org/10.1016/j.coelec.2020.01.006 Højkoncentrerede vandige elektrolytter, kendt som vand-i-salt elektrolytter, kunne være et alter -
 Saltning af omkostningerne ved proteinpolymerlægemidlerKredit:Carnegie Mellon University, Institut for Kemiteknik Protein er en stor forretning. Ikke alene udgør den en betydelig del af alle levende ting-det er også en industri på 150 milliarder dolla
Saltning af omkostningerne ved proteinpolymerlægemidlerKredit:Carnegie Mellon University, Institut for Kemiteknik Protein er en stor forretning. Ikke alene udgør den en betydelig del af alle levende ting-det er også en industri på 150 milliarder dolla
- Teslas administrerende direktør smider den seneste bombe med et opkøbsforslag på 72 milliarder do…
- Sedimentære klipper med krusningsmærker antyder, at de dannede hvor?
- Tencent Music-aktien stiger på første handelsdag
- Grønt brint:Kortsigtet knaphed, langsigtet usikkerhed
- Hvad er himmellegemer set om natten kaldet?
- Solen er 1 lys år væk fra jorden?


