Hvilke charaecteristik deler faste ioniske forbindelser?
Struktur og limning:
* Krystallinsk struktur: De har et meget ordnet, tredimensionelt arrangement af ioner kaldet en krystalgitter. Dette arrangement minimerer elektrostatisk frastødning og maksimerer tiltrækning.
* ionisk binding: De konstituerende ioner holdes sammen af stærke elektrostatiske kræfter til tiltrækning mellem modsat ladede ioner. Dette resulterer i en meget stærk bånd.
egenskaber:
* høje smelte- og kogepunkter: På grund af de stærke ioniske bindinger kræves betydelig energi for at bryde dem fra hinanden, hvilket resulterer i høje smelte- og kogepunkter.
* hårdt og sprødt: Den stive krystalstruktur gør dem hårde, men det ordnede arrangement gør dem sprøde. Hvis det rames, kan ionerne skifte, forstyrre den elektrostatiske balance og få krystallen til at bryde.
* Dårlige ledere af elektricitet i fast tilstand: Ionerne er fastgjort i deres positioner i krystalgitteret og forhindrer ladningsstrømmen.
* gode ledere af elektricitet i smeltet tilstand eller løsning: Når de er smeltet eller opløst, bliver ionerne fri til at bevæge sig, hvilket muliggør elektrisk ledningsevne.
* opløselighed: Mange ioniske forbindelser opløses i polære opløsningsmidler som vand, hvor de polære vandmolekyler kan interagere med og trække ionerne fra hinanden.
Andre egenskaber:
* Høj densitet: Den tæt pakket struktur af krystalgitteret fører til høj densitet.
* Typisk gennemsigtig eller gennemskinnelig: Arrangementet af ioner kan påvirke, hvordan lys passerer gennem forbindelsen.
Eksempler:
* Natriumchlorid (NaCl)
* Kaliumbromid (KBR)
* Calciumcarbonat (CACO3)
* Magnesiumoxid (MGO)
Husk, at der kan være nogle undtagelser fra disse egenskaber baseret på den specifikke ioniske forbindelse og dens struktur. De egenskaber, der er anført ovenfor, gælder imidlertid generelt for størstedelen af faste ioniske forbindelser.
 Varme artikler
Varme artikler
-
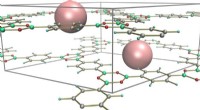 Porøse polymerer viser bemærkelsesværdig stabilitet ved højt trykPorøst nanomateriale kaldet COFer (kovalente organiske rammer). Kredit:Alexandr Talyzin Umeå-fysikere i samarbejde med Dresdens Tekniske Universitet og Chalmers Universitet er de første til at vis
Porøse polymerer viser bemærkelsesværdig stabilitet ved højt trykPorøst nanomateriale kaldet COFer (kovalente organiske rammer). Kredit:Alexandr Talyzin Umeå-fysikere i samarbejde med Dresdens Tekniske Universitet og Chalmers Universitet er de første til at vis -
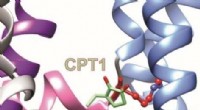 Forskere opdager molekylære mekanismer i en afrikansk folkemedicinUCI-forskere afslører, hvordan to komponenter af Mallotus-bladekstraktet binder til et tidligere ukendt bindingssted på KCNQ1, en kaliumkanal, der er afgørende for at kontrollere elektrisk aktivitet i
Forskere opdager molekylære mekanismer i en afrikansk folkemedicinUCI-forskere afslører, hvordan to komponenter af Mallotus-bladekstraktet binder til et tidligere ukendt bindingssted på KCNQ1, en kaliumkanal, der er afgørende for at kontrollere elektrisk aktivitet i -
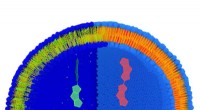 Måling af spændingen i en celle med et molekyleKunstnerens syn på en lipidmembran markeret med FliptR-molekylet. Lipiderne er blå (hydrofil del) og gule (hydrofob del). Når lipider strækkes (venstre del) har molekylet en kort levetid (grøn), hvori
Måling af spændingen i en celle med et molekyleKunstnerens syn på en lipidmembran markeret med FliptR-molekylet. Lipiderne er blå (hydrofil del) og gule (hydrofob del). Når lipider strækkes (venstre del) har molekylet en kort levetid (grøn), hvori -
 En kemisk omfavnelse fra den perfekte værtGengwu Zhang udfører adskillelseseksperimentet ved hjælp af to ekstraktionstårne. Kredit:© 2020 KAUST En industriel proces, der i øjeblikket bruger store mængder energi i petrokemiske anlæg rundt
En kemisk omfavnelse fra den perfekte værtGengwu Zhang udfører adskillelseseksperimentet ved hjælp af to ekstraktionstårne. Kredit:© 2020 KAUST En industriel proces, der i øjeblikket bruger store mængder energi i petrokemiske anlæg rundt
- For at forbedre målepindens diagnostiske og miljømæssige test, bare tilføje tape
- Fysikere foreslår perfekt materiale til lasere
- Bølger i søer laver bølger i Jorden
- Hvilken kombination af kromosomer resulterer i en dreng?
- Hvordan en formskiftende receptor påvirker cellevækst
- Studiet sporer alvorlige blegningsbegivenheder på et koralrev i Stillehavet i det sidste århundred…


