Hvor mange mol brom vil blive dannet ved den komplette reaktion 0,248 trifluorid?
For at bestemme molen af den dannede brom, har vi brug for den afbalancerede kemiske ligning for reaktionen.
Her er en generel tilgang til at løse denne type problem:
1. Skriv den afbalancerede kemiske ligning: Dette viser støkiometrien af reaktionen, hvilket indikerer molforholdene mellem reaktanter og produkter.
2. Identificer den begrænsende reaktant: Den begrænsende reaktant er den, der først forbruges fuldstændigt, hvilket bestemmer den maksimale produktmængde, der kan dannes.
3. Brug molforholdet fra den afbalancerede ligning: Molforholdet fortæller os, hvor mange mol brom der produceres til hver mol bromtrifluorid, der forbruges.
4. Beregn molen af brom: Multiplicer molen af den begrænsende reaktant med det relevante molforhold.
Eksempel:
Lad os antage, at reaktionen er:
2 BRF₃ + 3 H₂ → BR₂ + 6 HF
I dette eksempel har vi:
* 0,248 mol brf₃
* Vi er nødt til at kende molen af H₂ for at bestemme den begrænsende reaktant.
For at fortsætte skal du give følgende oplysninger:
* Den komplette afbalancerede kemiske ligning: Dette vil fortælle os støkiometrien af reaktionen.
* Mængden af den anden reaktant: Dette er nødvendigt for at bestemme den begrænsende reaktant.
Når du giver disse oplysninger, kan vi beregne molen af brom dannet.
Sidste artikelHvilke charaecteristik deler faste ioniske forbindelser?
Næste artikelHvilken er den mest sure pH 2 5 7 eller 11?
 Varme artikler
Varme artikler
-
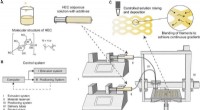 Additiv fremstilling af cellulosebaserede materialer med kontinuerlig, stigninger i flere retningerSkema af fremstillingsprocessen til udskrivning af kontinuerlige gradienter. (A) Skematisk fremstilling af udskrivningsløsninger. Hydroxyethylcellulose (HEC) i pulverform opløses i vand og blandes med
Additiv fremstilling af cellulosebaserede materialer med kontinuerlig, stigninger i flere retningerSkema af fremstillingsprocessen til udskrivning af kontinuerlige gradienter. (A) Skematisk fremstilling af udskrivningsløsninger. Hydroxyethylcellulose (HEC) i pulverform opløses i vand og blandes med -
 Forskere skræddersyer hovedgruppekatalysator med atomisk spredte In-steder til højeffektiv oxidati…Skematisk over det lokale koordinationsmiljø for isoleret In-sted og foreslået selektiv oxidativ dehydrogeneringsproces på hovedgruppe In-katalysator. Kredit:WANG Chaojie Overgangsmetaloxider er ka
Forskere skræddersyer hovedgruppekatalysator med atomisk spredte In-steder til højeffektiv oxidati…Skematisk over det lokale koordinationsmiljø for isoleret In-sted og foreslået selektiv oxidativ dehydrogeneringsproces på hovedgruppe In-katalysator. Kredit:WANG Chaojie Overgangsmetaloxider er ka -
 For en sand krig mod affald, modeindustrien skal bruge mere på forskningEn model bærer et af forfatterens originale zero waste designs. Stigningen af fast fashion i Australien betyder, at 6000 kg tøj bliver dumpet på lossepladsen hvert 10. minut. ABCs War On Waste v
For en sand krig mod affald, modeindustrien skal bruge mere på forskningEn model bærer et af forfatterens originale zero waste designs. Stigningen af fast fashion i Australien betyder, at 6000 kg tøj bliver dumpet på lossepladsen hvert 10. minut. ABCs War On Waste v -
 Mikrobielle cyborgs:Bakterier, der leverer strømBakterierne (grønne) er indlejret i en komposit fremstillet af carbon nanorør (grå) og silica nanopartikler (violet) sammenvævet med DNA (blå). (Grafik:Niemeyer Lab, KIT) Kredit:Grafik:Niemeyer Lab, K
Mikrobielle cyborgs:Bakterier, der leverer strømBakterierne (grønne) er indlejret i en komposit fremstillet af carbon nanorør (grå) og silica nanopartikler (violet) sammenvævet med DNA (blå). (Grafik:Niemeyer Lab, KIT) Kredit:Grafik:Niemeyer Lab, K
- En fejllinje i Californien er ved at krybe - kommer den store?
- Hvordan en harmløs miljøbakterie blev til den frygtede hospitalskim Acinetobacter baumannii
- Computermodel forklarer, hvordan dyr vælger handlinger med givende resultater
- Hvordan NASA vil vide, når InSight lander
- Banke, banke! Hvem der?
- Hvem besøgte månen først?


