Hvordan en harmløs miljøbakterie blev til den frygtede hospitalskim Acinetobacter baumannii
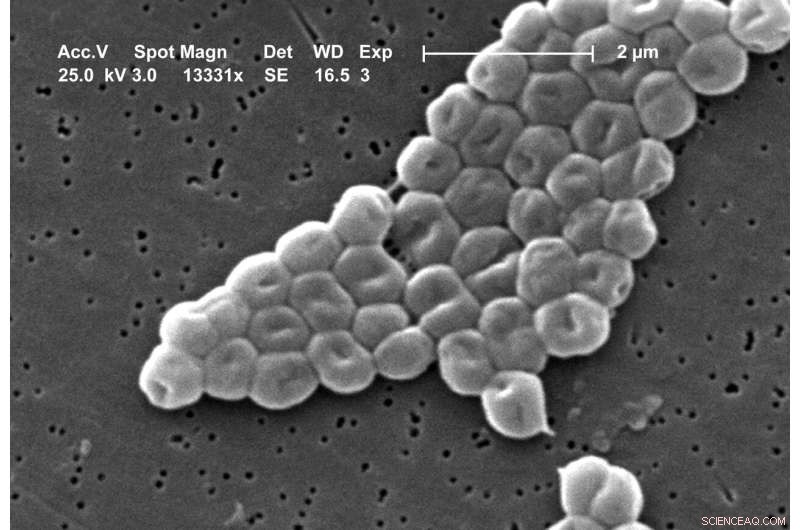
Scanningelektronmikrografi af en klynge af gramnegative, immobile bakterier af Acinetobacter baumannii-arterne. Kredit:Janice Carr, CDC's Public Health Image Library Billede #6498
Hvert år bliver mere end 670.000 mennesker i Europa syge på grund af patogene bakterier, der udviser antibiotikaresistens, og 33.000 dør af de sygdomme, de forårsager. Særligt frygtes patogener, der er resistente over for flere antibiotika på samme tid. Blandt dem er bakterien Acinetobacter baumannii, der i dag er frygtet frem for alt som en "hospital superbug". Op til fem procent af alle hospitalserhvervede bakterielle infektioner er forårsaget af denne kim alene.
A. baumannii er lige i toppen af en liste over kandidater, som der ifølge Verdenssundhedsorganisationen (WHO) skal udvikles nye terapier til. Dette skyldes, at patogenet – på grund af et fleksibelt genom – nemt erhverver ny antibiotikaresistens. Samtidig opstår infektioner ikke kun mere og mere uden for hospitalsmiljøet, men fører også til stadig mere alvorlig progression. En forudsætning for udviklingen af nye terapeutiske tilgange er imidlertid, at vi forstår, hvilke egenskaber der gør A. baumannii og dens humane patogene slægtninge, grupperet i det, der er kendt som Acinetobacter calcoaceticus-baumannii (ACB) komplekset, til et patogen.
Et hold ledet af bioinformatiker professor Ingo Ebersberger fra Goethe Universitet Frankfurt/LOWE Center for Translationel Biodiversitetsgenomik (LOEWE-TBG) har nu nået en milepæl i denne forståelse. Holdet er sammensat af medlemmer af Research Unit 2251 under German Research Foundation og andre nationale og internationale partnere, blandt dem forskere fra Washington University School of Medicine, St. Louis, USA.
Til deres analyse benyttede holdet sig af, at en stor del af medlemmerne af Acinetobacter-slægten er harmløse miljøbakterier, der lever i vand eller på planter eller dyr. Tusindvis af komplette genomsekvenser, både af disse såvel som af patogene Acinetobacter-stammer, er lagret i offentligt tilgængelige databaser.
Ved at sammenligne disse genomer var forskerne i stand til systematisk at bortfiltrere forskelle mellem de patogene og de harmløse bakterier. Fordi forekomsten af individuelle gener ikke var særlig afgørende, koncentrerede Ebersberger og hans kolleger sig om genklynger, det vil sige grupper af nabogener, der er forblevet stabile under evolutionen og kan danne en funktionel enhed. "Af disse evolutionært stabile genklynger identificerede vi 150, der er til stede i patogene Acinetobacter-stammer og sjældne eller fraværende i deres ikke-patogene slægtninge," siger Ebersberger og opsummerer. "Det er højst sandsynligt, at disse genklynger gavner patogenernes overlevelse i den menneskelige vært."
Blandt de vigtigste egenskaber ved patogener er deres evne til at danne beskyttende biofilm og til effektivt at absorbere mikronæringsstoffer som jern og zink. Og faktisk opdagede forskerne, at optagelsessystemerne i ACB-gruppen var en forstærkning af den eksisterende og evolutionære ældre optagelsesmekanisme.
Særligt spændende er det, at patogenerne åbenbart har udnyttet en særlig energikilde:de kan nedbryde kulhydratet kynurenin, som produceres af mennesker, og som som et budbringerstof regulerer det medfødte immunsystem. Bakterierne slår tilsyneladende to fluer med ét smæk på denne måde. På den ene side forsyner nedbrydning af kynurenin dem med energi, og på den anden side kan de muligvis bruge det til at deregulere værtens immunrespons.
Ebersberger er overbevist:"Vores arbejde er en milepæl i at forstå, hvad der er anderledes ved patogen Acinetobacter baumannii. Vores data er af så høj en opløsning, at vi endda kan se på situationen i individuelle stammer. Denne viden kan nu bruges til at udvikle specifikke terapier mod som med al sandsynlighed endnu ikke eksisterer modstand."
Deres undersøgelse er offentliggjort i PLOS Genetics .
Sidste artikelKan en mos hjælpe med at rense vandveje?
Næste artikelHvordan plesiosaurer svømmede under vandet
 Varme artikler
Varme artikler
-
 At lykkes, store havreservater skal være til gavn for både havets liv og menneskerKredit:Rebecca Gruby, CC BY-ND Der er stigende bekymring for, at verdenshavene er i krise på grund af klimaændringer, overfiskning, forurening og andre belastninger. Et svar er at skabe beskyttede
At lykkes, store havreservater skal være til gavn for både havets liv og menneskerKredit:Rebecca Gruby, CC BY-ND Der er stigende bekymring for, at verdenshavene er i krise på grund af klimaændringer, overfiskning, forurening og andre belastninger. Et svar er at skabe beskyttede -
 Hvordan langsomme muskelfibre overbeviser deres naboer om at slutte sig til demRspo3 udskilles fra langsomme type I fibre (ikke fra hurtige fibre), hvilket fremmer ophobningen af beta-catenin inde i myoblaster. Dette fører til den øgede produktion af MyHC I og den endelige dif
Hvordan langsomme muskelfibre overbeviser deres naboer om at slutte sig til demRspo3 udskilles fra langsomme type I fibre (ikke fra hurtige fibre), hvilket fremmer ophobningen af beta-catenin inde i myoblaster. Dette fører til den øgede produktion af MyHC I og den endelige dif -
 Hvad hjerneædende amøber kan fortælle os om mangfoldigheden af liv på jorden og evolutionær h…Naegleria gruberi-celler bruger et sæt tubuliner til at bygge en mitotisk spindel (cyan, venstre), og et andet sæt tubuliner (orange, højre) til at omdanne til en flagellatcelletype. Kredit:Katrina Ve
Hvad hjerneædende amøber kan fortælle os om mangfoldigheden af liv på jorden og evolutionær h…Naegleria gruberi-celler bruger et sæt tubuliner til at bygge en mitotisk spindel (cyan, venstre), og et andet sæt tubuliner (orange, højre) til at omdanne til en flagellatcelletype. Kredit:Katrina Ve -
 Falske øjenpletter skræmmer rovdyr, finder forskereEt eksempel på en fisk (Hemiscyllium ocellatum) med to store øjenpletter, en bag hver brystfinne. Indsat:En pindeback tøver med at angribe øjenlignende mønstre. Kredit:Karin Kjernsmo Den udbredte
Falske øjenpletter skræmmer rovdyr, finder forskereEt eksempel på en fisk (Hemiscyllium ocellatum) med to store øjenpletter, en bag hver brystfinne. Indsat:En pindeback tøver med at angribe øjenlignende mønstre. Kredit:Karin Kjernsmo Den udbredte
- Dele af et teleskop
- Atomiske terahertz-vibrationer løser gåden med ultrakorte soliton-molekyler
- Sorte og kvindelige hovedkandidater er mere tilbøjelige til at opleve forsinkede og nægtede forfre…
- DARPA prototype reflekterende antenne tilbyder høj ydeevne i en lille pakke
- Indiens rigeste mand løfter sløret for bredbåndsplan
- Miniaturiserede varmemotorer kunne drive fremtidens nanoskala -maskiner


