Måling af spændingen i en celle med et molekyle
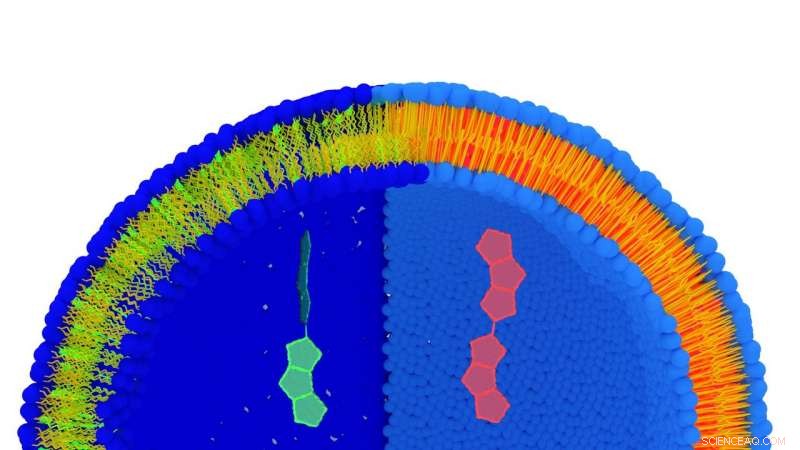
Kunstnerens syn på en lipidmembran markeret med FliptR-molekylet. Lipiderne er blå (hydrofil del) og gule (hydrofob del). Når lipider strækkes (venstre del) har molekylet en kort levetid (grøn), hvorimod når lipiderne er mere kompakte, dens levetid er lang (rød). Begge konformationer er vist i stor skala i midten af billedet. Kredit:© UNIGE
Volumenet af celler kan variere dramatisk. På samme måde som en oppustelig ballon, volumenforøgelsen af voksende celler skubber på plasmamembranen - lipidkappen, der omgiver cellen. Dette "turgor" tryk øger spændingen af membranen, hvilken, hvis den ikke rettes, vil i sidste ende få cellen til at briste. For at forhindre dette i at ske, celler har udviklet mekanismer til at overvåge spændingen af deres plasmamembran. Når spændingen er for høj, celler reagerer ved at øge mængden af lipid i membranen. Omvendt når spændingen er for lav, celler fjerner lipid fra membranen for at "stramme" den. Hvordan celler formår at mærke spændinger og udløse den passende biologiske reaktion er forblevet et mysterium. Det har været svært at løse på grund af mangel på værktøjer til at studere membranspændinger i levende celler. For at løse dette problem, forskere fra Universitetet i Genève (UNIGE) og National Center for Competence in Research Chemical Biology (NCCR) har samarbejdet om at skabe et fluorescerende molekyle til at måle spændingen i plasmamembranen af levende celler. Ved at bruge dette nye værktøj, de var derefter i stand til at opdage, hvordan celler tilpasser deres overflade til deres volumen. Disse resultater, udgivet i Naturkemi og Naturens cellebiologi , bane vejen for mange anvendelser, herunder ved påvisning af kræftceller, der typisk udviser afvigende høj membranspænding.
Når volumen af en celle øges, spændingen på dens membran øges, forårsager aktivering af TORC2 - et kompleks af proteiner, der skaber advarselssignaler i cellen. "Cellemembranen består af lipider organiseret i et semipermeabelt dobbeltlag, " forklarer Aurélien Roux, professor ved Institut for Biokemi ved Det Naturvidenskabelige Fakultet i UNIGE og medlem af NCCR. "Denne overflade er flydende, tillader stor tilpasningsevne af membranen til ændringer i cellens form og volumen. Som enhver overflade, det kan strækkes, og mellemrummet mellem lipiderne øges. Når dette rum bliver for stort, og membranen er i fare for at gå i stykker, et protein, ved navn Slm1, aktiverer TORC2 til at producere signaler, der skubber cellen til at producere nye lipider og igen reducerer spændingen i cellemembranen." Men hvordan kunne forskerne måle den spænding, der er nødvendig for at udløse denne proces?
For at evaluere spændingen af cellemembranen, det er nødvendigt at kunne måle mellemrummet mellem lipiderne, der udgør denne membran. Stefan Matile, professor ved Institut for Organisk Kemi ved Det Naturvidenskabelige Fakultet i UNIGE og medlem af NCCR, har skabt et "probe-molekyle" kaldet FliptR (Fluorescent Lipid Tension Reporter), som integreres spontant mellem lipiderne i plasmamembranen. "Vi har udviklet et fluorescerende molekyle med to små "finner", der definerer en vis vinkel mellem dem, forklarer han. Denne vinkel varierer afhængigt af det tryk, der udøves på FliptR, som ændrer dets fluorescens." Ved at udnytte denne forskel i molekylets fluorescensegenskaber, gruppen af professor Roux var i stand til at måle mellemrummet mellem lipiderne og derfor spændingen af en membran.
FliptR er et værdifuldt nyt værktøj til at måle spændingen af plasmamembranen i levende celler. "Vi ved, at kræftceller har højere membranspænding end normale celler. Vi håber, at dette fluorescerende molekyle en dag vil hjælpe med at opdage dem lettere, " siger Stefan Matile.
Og når det kommer til at reducere spændingen i cellen?
Når spændingen af plasmamembranen stiger, TORC2 aktiveres, og dette udløser produktionen af lipider for at sænke spændingen tilbage til basale værdier. Men hvad sker der, når spændingen i membranen er for lav og skal øges? "Vi troede oprindeligt, at det skete gennem den samme mekanisme, der kørte omvendt, men historien viste sig at være meget mere interessant, " siger Robbie Loewith, professor ved Institut for Molekylær Biologi ved UNIGE Fakultet for Naturvidenskab og også medlem af NCCR. Ja, indledende forskning viste, at TORC2-aktivatoren Slm1 - involveret i at fornemme høj membranspænding - overraskende nok ikke spiller nogen rolle i responsen på for lidt spænding. "På den anden side, vi observerede, at et bestemt lipid til stede i plasmamembranen, kaldet PIP2, er sensoren til lav membranspænding."
Når membranspændingen falder, PIP2, tidligere blandet med andre lipider, selvudskiller sig for at danne PIP2 "øer" i et hav af resterende lipider i membranen, i en proces ikke ulig den spontane adskillelse (hævning) af fløde i frisk mælk. Da et af proteinerne i TORC2 binder PIP2, TORC2 omdistribuerer også til disse PIP2-øer. En gang opslugt af disse holme, TORC2 bliver inaktiveret. "Lipiderne i cellemembranen nedbrydes naturligt, og TORC2-aktivitet er nødvendig for at erstatte dem" forklarer Robbie Loewith. Men når TORC2 hæmmes i PIP2-øerne, de nedbrudte lipider erstattes ikke længere, resulterer i en stigning i spændingen af plasmamembranen. Hvis denne genkalibreringsproces er blokeret, celler kan ikke justere spændingen af deres plasmamembran og dør.
Et kemisk måleværktøj til at hjælpe forskning i biologi
Takket være spændingsmålingsteknikken udviklet af Stefan Matile og Aurélien Roux, teamene af professorer Roux og Loewith kunne udføre deres eksperimenter på gær og måle spændingsvariationerne i plasmamembranen. Membranspænding er en meget vigtig parameter at kontrollere i alle cellulære processer, hvori membraner er involveret, såsom motilitet, endocytose (den proces, hvorigennem cellen føder sig selv), eller celledeling, og især i tilfælde af kræftudvikling. Forskerne fokuserer nu på at kontrollere, om mekanismen observeret i gær er den samme i menneskelige celler, med den langsigtede idé at udvikle lægemidler, der er i stand til at regulere TORC2, eller endda for at forhindre udviklingen af visse kræftformer.
 Varme artikler
Varme artikler
-
 Ud af tyk luft:Omdannelse af kuldioxid til lysemitterende kulstofDette billede viser lysudsendelse, en proces kendt som fotoluminescens, danne fast kulstof, som er dannet på en sølv nanostruktur, oplyst af grønt lys. Kredit:University of Ottawa, OSA Optica Et t
Ud af tyk luft:Omdannelse af kuldioxid til lysemitterende kulstofDette billede viser lysudsendelse, en proces kendt som fotoluminescens, danne fast kulstof, som er dannet på en sølv nanostruktur, oplyst af grønt lys. Kredit:University of Ottawa, OSA Optica Et t -
 Video:Hvorfor du ikke kan købe friske olivenKredit:The American Chemical Society Oliven vokser på træer. Så hvorfor har du aldrig set en frisk, træmodnet oliven i produktafdelingen i købmanden? Hvorfor svømmer de altid i saltlage? Åh, og
Video:Hvorfor du ikke kan købe friske olivenKredit:The American Chemical Society Oliven vokser på træer. Så hvorfor har du aldrig set en frisk, træmodnet oliven i produktafdelingen i købmanden? Hvorfor svømmer de altid i saltlage? Åh, og -
 Spild ikke, vil ikke:en hjemmelavet plan om at gøre plast og dæk til brændstofKredit:Monash University Reducere, genbruge, genbruge. Som at børste tænder efter et måltid, genbrug er bare det rigtige at gøre. Men nu hvor Kina er holdt op med at tage vores skraldespand, vi k
Spild ikke, vil ikke:en hjemmelavet plan om at gøre plast og dæk til brændstofKredit:Monash University Reducere, genbruge, genbruge. Som at børste tænder efter et måltid, genbrug er bare det rigtige at gøre. Men nu hvor Kina er holdt op med at tage vores skraldespand, vi k -
 Sådan beregnes AlkalinityAlkalinitet er det kemiske modsætning til surhedsgraden. Mens surhedsgrad viser sig som en lav pH-aflæsning og repræsenterer et stofs kapacitet til at donere en proton eller hydrogenion (H +), viser
Sådan beregnes AlkalinityAlkalinitet er det kemiske modsætning til surhedsgraden. Mens surhedsgrad viser sig som en lav pH-aflæsning og repræsenterer et stofs kapacitet til at donere en proton eller hydrogenion (H +), viser
- Kemikere opdager en enklere metode til fremstilling af vidundermateriale
- Dominerer hvide mennesker udendørs?
- Hvad skal man gøre, når det ikke længere er nok at reducere emissionerne alene
- Maskinindlæringsteknik kunne forbedre fusionsenergi-output
- Bedst i sne:Ny videnskabelig enhed skaber elektricitet fra snefald
- Matematisk model bekræfter en korrekt forståelse af epidemiers sværhedsgrad


