Hvad er eksemplet på en forbindelse?
almindelige forbindelser:
* vand (H₂O): To hydrogenatomer bundet til et iltatom.
* salt (NaCl): Et natriumatom bundet til et chloratom.
* sukker (c₁₂h₂₂o₁₁): Mange kulstof-, brint- og iltatomer bundet sammen.
* kuldioxid (co₂): Et carbonatom bundet til to iltatomer.
* ammoniak (NH₃): Et nitrogenatom bundet til tre hydrogenatomer.
mere komplekse forbindelser:
* ethanol (C₂H₅OH): En almindelig alkohol, der findes i drikkevarer.
* aspirin (c₉h₈o₄): En almindelig smerteaflastning.
* koffein (c₈h₁₀n₄o₂): Et stimulerende middel fundet i kaffe og te.
* glukose (c₆h₁₂o₆): Et simpelt sukker, der findes i mange fødevarer.
* natriumbicarbonat (Nahco₃): Bagepulver.
Nøgleegenskaber ved forbindelser:
* fast forhold: Elementerne i en forbindelse kombineres altid i et specifikt, fast forhold efter masse. For eksempel har vand altid to hydrogenatomer til hvert iltatom.
* Nye egenskaber: Forbindelser har egenskaber, der er forskellige fra de elementer, der udgør dem. For eksempel er vand en væske ved stuetemperatur, mens brint og ilt er gasser.
* Kemisk ændring: Forbindelser kan kun dannes eller nedbrydes gennem kemiske reaktioner.
Fortæl mig, hvis du vil have eksempler på specifikke typer forbindelser, som organiske forbindelser, uorganiske forbindelser eller ioniske forbindelser!
Sidste artikelHvordan påvirker surt regnmaterialer?
Næste artikelVand H2O er et eksempel på en?
 Varme artikler
Varme artikler
-
 Forskere gør vigtige fremskridt for at printe kredsløb på bærbare stofferPerovskite struktur. Kredit:OSU College of Engineering Elektroniske skjorter, der holder brugeren behagelig varm eller kølig, såvel som medicinske stoffer, der leverer lægemidler, overvåge tilstan
Forskere gør vigtige fremskridt for at printe kredsløb på bærbare stofferPerovskite struktur. Kredit:OSU College of Engineering Elektroniske skjorter, der holder brugeren behagelig varm eller kølig, såvel som medicinske stoffer, der leverer lægemidler, overvåge tilstan -
 Divalent guldkompleks isoleret for første gang i ren formGuld i sin divalente form er stabilt i midten af porfyriner. Kredit:Katja Heinze, JGU Ifølge lærebogsviden, de sædvanlige oxidationstilstande for guld i forbindelser er +I og +III. Den divalente
Divalent guldkompleks isoleret for første gang i ren formGuld i sin divalente form er stabilt i midten af porfyriner. Kredit:Katja Heinze, JGU Ifølge lærebogsviden, de sædvanlige oxidationstilstande for guld i forbindelser er +I og +III. Den divalente -
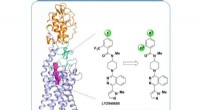 Forskere dechifrerer multi-domænet, struktur i fuld længde af den menneskelige glattede receptorStruktur af multi-domæne human Smoothened receptor, et vigtigt lægemiddelmål for kræftsygdomme. Kredit:ShanghaiTech University Et team af forskere ledet af iHuman Institute of ShanghaiTech Univers
Forskere dechifrerer multi-domænet, struktur i fuld længde af den menneskelige glattede receptorStruktur af multi-domæne human Smoothened receptor, et vigtigt lægemiddelmål for kræftsygdomme. Kredit:ShanghaiTech University Et team af forskere ledet af iHuman Institute of ShanghaiTech Univers -
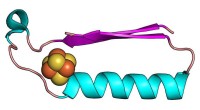 Forskere har opdaget oprindelsen til livets byggestenEn fold (form), der kan have været et af de tidligste proteiner i udviklingen af metabolisme. Kredit:Vikas Nanda/Rutgers University Rutgers forskere har opdaget oprindelsen til proteinstrukturer
Forskere har opdaget oprindelsen til livets byggestenEn fold (form), der kan have været et af de tidligste proteiner i udviklingen af metabolisme. Kredit:Vikas Nanda/Rutgers University Rutgers forskere har opdaget oprindelsen til proteinstrukturer


