Forskere dechifrerer multi-domænet, struktur i fuld længde af den menneskelige glattede receptor
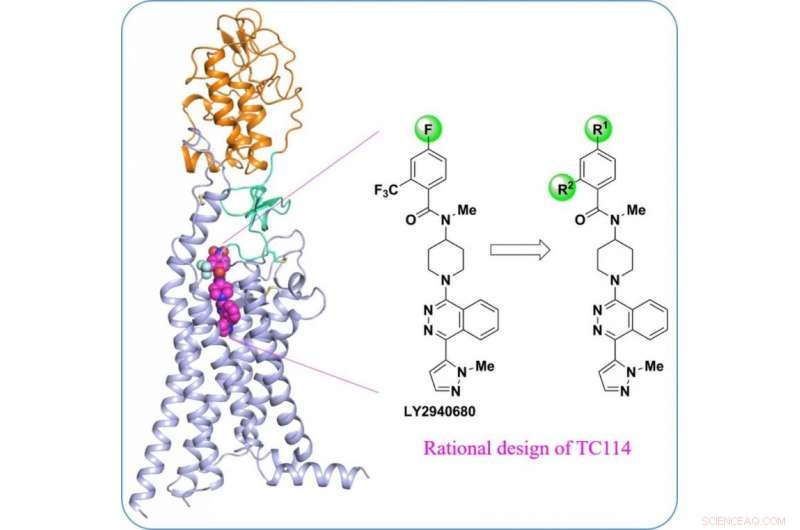
Struktur af multi-domæne human Smoothened receptor, et vigtigt lægemiddelmål for kræftsygdomme. Kredit:ShanghaiTech University
Et team af forskere ledet af iHuman Institute of ShanghaiTech University i samarbejde med Fudan University har bestemt den højopløselige krystalstruktur af den multidomæne humane glattede receptor. Resultaterne illustrerer de allosteriske domæne-domæne-interaktioner inden for receptoren, og deres rolle i udjævnet aktivering. Disse nye resultater offentliggøres den 17. maj, 2017 i Naturkommunikation , med titlen "Krystalstruktur af en multi-domæne human glattet receptor i kompleks med en superstabiliserende ligand, " af Zhang X-J et al.
Som en central aktør i Hedgehog-signalvejen involveret i embryonal udvikling og tumorgenese, den glattede receptor (SMO) har været længe eftertragtet som et lægemiddelmål for adskillige kræftformer. Lægemiddelresistens har dog været et problem på grund af mutationer i SMO. "Udvikling af næste generations anti-SMO-lægemidler vil blive lettet ved at forstå multidomæne-arrangementet i SMO-strukturen", sagde Fei Xu, Adjunkt ved iHuman Institute, ShanghaiTech University, og hovedforfatteren af dette papir. "Denne struktur vil give os mulighed for at identificere potentielt nye ligandbindingssteder og signalmekanismer."
"For at stabilisere det humane SMO-protein med flere domæner, vi designet en række kemiske værktøjsforbindelser", sagde Houchao Tao, Forskningslektor ved iHuman Institute. "TC114 er en sonde, der signifikant stabiliserer og låser receptoren i en enkelt konformation." Med yderligere optimering, Ph.d.-studerende Xianjun Zhang løste multidomæne-SMO-strukturen bundet til TC114 ved 2,9 angstrøm ved hjælp af røntgenfri elektronlaser. "Denne struktur afslører hængseldomænet, der kan spille vigtige modulerende roller ved at forbinde domænerne, giver tip til udviklingen af nye modulatorer rettet mod denne region", sagde Xianjun Zhang.
"Dette er smukt teamwork", sagde Raymond Stevens, direktør for iHuman Institute, ShanghaiTech University, "kemi og biologi er knyttet sammen i denne videnskab for at forstå strukturen og funktionen af denne komplekse multidomæne-receptor. Krystalstrukturen, på tur, åbner nye veje for lægemiddelopdagelse."
 Varme artikler
Varme artikler
-
 Vil du diagnosticere hjernesygdomme? En massespektrometri -billeddannelse kan en dag hjælpe digFigur 1:(a) Skematisk af målesystemet udviklet i denne undersøgelse. Ved at bruge denne teknologi, udvinding og ionisering af picolitervolumener kan udføres uden forstyrrelser forårsaget af overflader
Vil du diagnosticere hjernesygdomme? En massespektrometri -billeddannelse kan en dag hjælpe digFigur 1:(a) Skematisk af målesystemet udviklet i denne undersøgelse. Ved at bruge denne teknologi, udvinding og ionisering af picolitervolumener kan udføres uden forstyrrelser forårsaget af overflader -
 Bestemmelse af krystalstrukturen af en DNA-stabiliseret sølv nanoclusterKredit:Angewandte Chemie Nanoclusters er små dynger af nogle få atomer, der ofte har interessante optiske egenskaber og kan blive nyttige prober til billeddannelsesprocesser inden for områder som
Bestemmelse af krystalstrukturen af en DNA-stabiliseret sølv nanoclusterKredit:Angewandte Chemie Nanoclusters er små dynger af nogle få atomer, der ofte har interessante optiske egenskaber og kan blive nyttige prober til billeddannelsesprocesser inden for områder som -
 Forskere finder en ny forbindelse mellem cellemetabolisme og celledelingKredit:CC0 Public Domain Processerne i levende væsener følger en fint orkestreret koreografi ned på molekylært niveau. Rytmiske processer findes overalt i biologien, for eksempel, døgnets døgncykl
Forskere finder en ny forbindelse mellem cellemetabolisme og celledelingKredit:CC0 Public Domain Processerne i levende væsener følger en fint orkestreret koreografi ned på molekylært niveau. Rytmiske processer findes overalt i biologien, for eksempel, døgnets døgncykl -
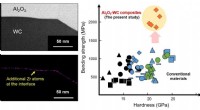 Brug af zirconium som tilsætningsstof i superstærke kompositmaterialerForskere ved Nagoya Universitet, arbejder i samarbejde med NGK Spark Plug Co., Ltd., har udviklet et sæt kompositmaterialer sammensat af lag af aluminiumoxid (Al2O3) og wolframcarbid (WC) med zirconiu
Brug af zirconium som tilsætningsstof i superstærke kompositmaterialerForskere ved Nagoya Universitet, arbejder i samarbejde med NGK Spark Plug Co., Ltd., har udviklet et sæt kompositmaterialer sammensat af lag af aluminiumoxid (Al2O3) og wolframcarbid (WC) med zirconiu
- Havstrømme bringer gode nyheder for revfiskene
- Sådan tilslutter vi varmepumper
- Kemikere bruger lys til at bygge biologisk aktive forbindelser
- Wavenumber til Wavelength Conversion
- Ny planlægningsmodel sætter flyselskaberne på lige plan og letter samtidig trængsel
- Blødere, forarbejdede fødevarer ændrede den måde, oldtidens mennesker talte på


