Hvilken svag base i kombination med dens syre hjælper med at puffe blod pH?
Sådan fungerer det:
* bicarbonat (HCO3-) er en svag base, der kan acceptere protoner (H+).
* kulsyre (H2CO3) er en svag syre, der kan donere protoner (H+).
Bufferingshandling:
* Når blod -pH stiger (bliver mere alkalisk) , carbonsyren (H2CO3) donerer en proton til at neutralisere overskydende base, danner bicarbonat (HCO3-) og vand (H2O).
* Når blod pH falder (bliver mere surt) , Bicarbonatet (HCO3-) accepterer en proton, der danner kulsyre (H2CO3).
Denne reversible reaktion opretholder et stabilt pH -område i blodet, typisk mellem 7,35 og 7,45.
Andre faktorer:
Mens bicarbonatbuffersystemet er den primære mekanisme, bidrager andre buffersystemer også til regulering af blod -pH, herunder:
* phosphatbuffer System: Dette system involverer ligevægt mellem dihydrogenphosphat (H2PO4-) og monohydrogenphosphat (HPO42-).
* Proteinbuffer System: Proteiner i blodet kan fungere som både syrer og baser, hvilket hjælper med at neutralisere pH -svingninger.
Betydningen af blod pH:
Opretholdelse af en stabil blod -pH er afgørende for korrekt cellefunktion og generel sundhed. Afvigelser fra det normale interval kan føre til alvorlige sundhedsmæssige problemer.
Sidste artikelHvordan fungerer bicarbonatet i plasma?
Næste artikelHvad er farven på methylorange i alkalisk medium?
 Varme artikler
Varme artikler
-
 Lille pumpe bygger polyrotaxaner med præcisionNorthwestern University forskere har udviklet den mest præcise måde at bygge polyrotaxaner på, en mekanisk låst polymer til glidering geler, batterielektrodematerialer og platforme til levering af læg
Lille pumpe bygger polyrotaxaner med præcisionNorthwestern University forskere har udviklet den mest præcise måde at bygge polyrotaxaner på, en mekanisk låst polymer til glidering geler, batterielektrodematerialer og platforme til levering af læg -
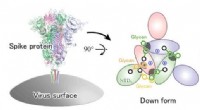 Glykaner er afgørende for COVID-19-infektionMolekylær mekanisme, der ligger til grund for den strukturelle ændring af SARS-CoV-2 spike-proteinet. Kredit:RIKEN En forskergruppe ved RIKEN Center for Computational Science (R-CCS) har fundet ud
Glykaner er afgørende for COVID-19-infektionMolekylær mekanisme, der ligger til grund for den strukturelle ændring af SARS-CoV-2 spike-proteinet. Kredit:RIKEN En forskergruppe ved RIKEN Center for Computational Science (R-CCS) har fundet ud -
 Farvede broderitråde efter behov sparer tid, penge og miljøKredit:Coloreel Det svenske firma Coloreel annoncerer partnerskab med Ricoh, den japanske teknologigigant, at revolutionere tekstilindustrien. Partnerskabet vil lancere en EU-støttet innovation, s
Farvede broderitråde efter behov sparer tid, penge og miljøKredit:Coloreel Det svenske firma Coloreel annoncerer partnerskab med Ricoh, den japanske teknologigigant, at revolutionere tekstilindustrien. Partnerskabet vil lancere en EU-støttet innovation, s -
 Kemi baner vejen for forbedrede elektroniske materialerEt tyndt lag indiumnitrid på siliciumcarbid, skabt ved hjælp af molekylet udviklet af forskere ved Linköpings universitet, Sverige. Kredit:Magnus Johansson/Linköpings universitet Indiumnitrid er e
Kemi baner vejen for forbedrede elektroniske materialerEt tyndt lag indiumnitrid på siliciumcarbid, skabt ved hjælp af molekylet udviklet af forskere ved Linköpings universitet, Sverige. Kredit:Magnus Johansson/Linköpings universitet Indiumnitrid er e
- Amazonas skovrydning og brande er en fare for folkesundheden
- Undersøgelse af lovende fotovoltaisk materiale fører til opdagelse af en ny stoftilstand
- Hvilken art er Lirpa -loof relateret til?
- Gennemgang af seksuelt misbrug af børn:Hvordan forskning kan hjælpe med at tackle vækst online
- Organiske 2-oxocarboxylsyrer giver forbindelse til dannelse af radikaler og reaktive iltarter i atmo…
- Løsnærende og opløftende, ikke bulldozing


