Hvad er resultatet, hvis stearinsyre tilsat i chloroform?
* stearinsyre er en fedtsyre: Den har en lang, ikke-polær carbonhydridkæde med en polær carboxylgruppe (-COOH) i den ene ende. Dette gør det til en hydrofobt Molekyle (vandhating).
* chloroform er et ikke -polært opløsningsmiddel: Det mangler evnen til at danne stærke brintbindinger med den polære carboxylgruppe af stearinsyre.
Derfor er samspillet mellem stearinsyre og chloroform primært baseret på van der Waals Forces , som er svage attraktioner mellem molekyler. Disse kræfter er ikke stærke nok til at overvinde den hydrofobe karakter af stearinsyre, hvilket resulterer i begrænset opløselighed.
hvad du måske observerer:
* Du kan se, at nogle stearinsyre opløses i chloroform, men flertallet vil sandsynligvis forblive som et fast stof i bunden af beholderen.
* Opløsningen kan forekomme lidt overskyet eller mælkeagtig på grund af tilstedeværelsen af uopløst stearinsyre.
Vigtig note: Mens stearinsyre har begrænset opløselighed i chloroform, er den mere opløselig i andre ikke -polære opløsningsmidler som diethylether og benzen.
Sidste artikelHvad er vigtigheden af pH -skala?
Næste artikelHvad er opløseligheden af benzoesyre i chloroform?
 Varme artikler
Varme artikler
-
 Hvordan sukkerelskende mikrober kan hjælpe med at drive fremtidige bilerGenmanipulerede bakterier kan omdanne glucose til en fedtsyre, som derefter kan omdannes til kulbrinter kaldet olefiner. For at dyrke sådanne bakterier tilføjer videnskabsmænd mikroberne til kolber fy
Hvordan sukkerelskende mikrober kan hjælpe med at drive fremtidige bilerGenmanipulerede bakterier kan omdanne glucose til en fedtsyre, som derefter kan omdannes til kulbrinter kaldet olefiner. For at dyrke sådanne bakterier tilføjer videnskabsmænd mikroberne til kolber fy -
 Ultratynde lag af rust genererer elektricitet fra strømmende vandKredit:Morteza Akhnia/Unsplash Der er mange måder at generere elektricitet på – batterier, solpaneler, vindturbine, og vandkraftdæmninger, for at nævne et par eksempler... og nu, der er rust. Ny
Ultratynde lag af rust genererer elektricitet fra strømmende vandKredit:Morteza Akhnia/Unsplash Der er mange måder at generere elektricitet på – batterier, solpaneler, vindturbine, og vandkraftdæmninger, for at nævne et par eksempler... og nu, der er rust. Ny -
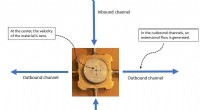 Strækning og flow:Forskning belyser usædvanlige egenskaber ved kendte materialerDen udvidede strøm blev genereret i den udgående kanal. Kredit:OIST Tandpasta, ansigtscremer, hårgelé, mayonnaise og ketchup er husholdningsartikler, som de fleste mennesker ikke tænker to gange o
Strækning og flow:Forskning belyser usædvanlige egenskaber ved kendte materialerDen udvidede strøm blev genereret i den udgående kanal. Kredit:OIST Tandpasta, ansigtscremer, hårgelé, mayonnaise og ketchup er husholdningsartikler, som de fleste mennesker ikke tænker to gange o -
 Bakterielle enzymer:Europiums biologiske rollePå billedet er den største fumarole (La Bocca Grande) i Solfatara-krateret vist, hvor den REE-afhængige bakterie Methylacidiphilum fumariolicum SolV først blev opdaget. Kredit:Huub Op den Camp Rar
Bakterielle enzymer:Europiums biologiske rollePå billedet er den største fumarole (La Bocca Grande) i Solfatara-krateret vist, hvor den REE-afhængige bakterie Methylacidiphilum fumariolicum SolV først blev opdaget. Kredit:Huub Op den Camp Rar


