Bevæger natrium- og chloridioner rundt parvis, når opløsningen?
Her er hvorfor:
* ioniske forbindelser: Natriumchlorid (NaCl), almindeligt bordsalt, er en ionisk forbindelse. Dette betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* opløsning i vand: Når NaCl opløses i vand, omgiver vandmolekylerne ionerne og bryder de ioniske bindinger. Den positive ende af vandmolekylet (brint) tiltrækkes af det negative chloridion, og den negative ende af vandmolekylet (ilt) tiltrækkes af den positive natriumion. Denne proces kaldes hydrering.
* Gratis ioner: Når de er opløst, bliver natrium- og chloridioner omgivet af vandmolekyler og bevæger sig uafhængigt under hele opløsningen. De er ikke længere bundet sammen, da de var i den faste krystal.
Kort sagt: Ionerne kan frit bevæge sig uafhængigt i en løsning, ikke bundet som par.
Sidste artikelHvad forstår du ved permuitit, hvordan er udmattet zeolit regenreret?
Næste artikelHvilken form er molekyler i vanddamp?
 Varme artikler
Varme artikler
-
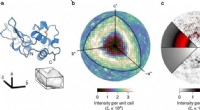 Forskere kortlægger proteinbevægelseret bånddiagram over lysozym (øverst) og den trikliniske enhedscelle, der indeholder et protein (nederst). b Der blev opnået et meget detaljeret tredimensionelt kort over diffus spredning. Den ydre kug
Forskere kortlægger proteinbevægelseret bånddiagram over lysozym (øverst) og den trikliniske enhedscelle, der indeholder et protein (nederst). b Der blev opnået et meget detaljeret tredimensionelt kort over diffus spredning. Den ydre kug -
 Undersøgelse afslører en kontinuerlig vej til livets byggestenGenerering af målmolekyler, der er relevante for livets oprindelse i et komplekst kemisk netværk drevet af stråling. Kredit:Ruiqin Yi, ELSI Forskere har længe søgt at forstå oprindelsen af liv p
Undersøgelse afslører en kontinuerlig vej til livets byggestenGenerering af målmolekyler, der er relevante for livets oprindelse i et komplekst kemisk netværk drevet af stråling. Kredit:Ruiqin Yi, ELSI Forskere har længe søgt at forstå oprindelsen af liv p -
 Høst rent brintbrændstof gennem kunstig fotosynteseDet farvede elektronmikroskopbillede viser galliumnitridtårnene i den kunstige fotosynteseanordning ved 52,5k forstørrelse. Disse nanostrukturer river vandmolekyler fra hinanden til brint og ilt for a
Høst rent brintbrændstof gennem kunstig fotosynteseDet farvede elektronmikroskopbillede viser galliumnitridtårnene i den kunstige fotosynteseanordning ved 52,5k forstørrelse. Disse nanostrukturer river vandmolekyler fra hinanden til brint og ilt for a -
 Multifunktionelle drømkeramiske matrixkompositter fødes(Øverst til venstre) Dette er en struktur af Ti-spredt AI 2 O 3 kompositter (nederst til venstre) Ti -indhold afhængighed af brud ruhed og elektrisk resistivitet (midten) Nanostruktur af overflade
Multifunktionelle drømkeramiske matrixkompositter fødes(Øverst til venstre) Dette er en struktur af Ti-spredt AI 2 O 3 kompositter (nederst til venstre) Ti -indhold afhængighed af brud ruhed og elektrisk resistivitet (midten) Nanostruktur af overflade
- Hvad er rækkefølgen af begivenhedernes rækkefølge i befrugtningen af et æg?
- Føler du, at nogen ser på? Du har sikkert ret
- Hvad er den første stjerne, du ser på den sydlige halvkugle?
- Undersøgelse kaster lys over, hvordan modstridende processer opstår inden for en enkelt celle
- Hvad kan lave huller i sten?
- Fungerer temperaturen som en katalysator?


