I hvilken gruppe har elementerne, som ORM -oxider har generel formel M2O3?
Her er hvorfor:
* Valenselektroner: Gruppe 13 -elementer har tre valenselektroner.
* Oxidationstilstand: De mister typisk disse tre elektroner for at opnå en stabil ædelgaskonfiguration, hvilket resulterer i en +3 oxidationstilstand.
* Dannelse af m₂o₃: For at danne et neutralt oxid kombineres to metalatomer (M) med en +3 -ladning hver med tre iltatomer (O) med en -2 -ladning, hvilket fører til formlen M₂O₃.
Eksempler på gruppe 13 -oxider med M₂O₃ -formel:
* Aluminiumoxid (al₂o₃)
* Galliumoxid (ga₂o₃)
* Indiumoxid (in₂o₃)
* Thallium (iii) oxid (tl₂o₃)
Bemærk: Mens nogle elementer i andre grupper kan danne oxider med M₂O₃ -formlen under specifikke forhold, udviser gruppe 13 -elementer konsekvent denne egenskab på grund af deres elektroniske konfiguration.
 Varme artikler
Varme artikler
-
 Ny teknologi omdanner biomasse til kulKredit:University of Nottingham University of Nottingham samarbejder med Energy Research Accelerator (ERA) og CPL Industries om at producere en kommerciel anlæg, der er i stand til at omdanne biom
Ny teknologi omdanner biomasse til kulKredit:University of Nottingham University of Nottingham samarbejder med Energy Research Accelerator (ERA) og CPL Industries om at producere en kommerciel anlæg, der er i stand til at omdanne biom -
 Forskere kommer op med en hurtigere måde at opdage antibiotika påKredit:Elena Khavina/MIPT Pressekontor Russiske biokemikere har identificeret en lovende ny klasse af antibiotika. Efter at have studeret over 125, 000 molekyler, de fandt, at 2-pyrazol-1-yl-thiaz
Forskere kommer op med en hurtigere måde at opdage antibiotika påKredit:Elena Khavina/MIPT Pressekontor Russiske biokemikere har identificeret en lovende ny klasse af antibiotika. Efter at have studeret over 125, 000 molekyler, de fandt, at 2-pyrazol-1-yl-thiaz -
 Dansende stof:Ny form for bevægelse af cykliske makromolekyler opdagetTil venstre:Øjebliksbillede af en ringpolymer ved oppustningsfasen i kraftig forskydning, ses som en projektion ind i flow-vorticity-planet. De stiplede blå linjer markerer polymerens massemiddelakser
Dansende stof:Ny form for bevægelse af cykliske makromolekyler opdagetTil venstre:Øjebliksbillede af en ringpolymer ved oppustningsfasen i kraftig forskydning, ses som en projektion ind i flow-vorticity-planet. De stiplede blå linjer markerer polymerens massemiddelakser -
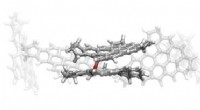 Molekylær dans, der kunne eliminere sodforureningReaktiv dimerisering af pi-diradikaler. Kredit:Jacob Martin En skjult, nyopdaget molekylær dans kunne rumme svaret på problemet med sodforurening. Sodforurening forårsager kræft og blodpropper, s
Molekylær dans, der kunne eliminere sodforureningReaktiv dimerisering af pi-diradikaler. Kredit:Jacob Martin En skjult, nyopdaget molekylær dans kunne rumme svaret på problemet med sodforurening. Sodforurening forårsager kræft og blodpropper, s
- Glitrende måne står op foran super blodmåne
- Håndtering af billioner af supercomputer -filer blev bare enklere
- Blev brugt til at finde en Jupiter-størrelse planet gennem omhyggelige målinger?
- Undersøgelse fremhæver faldgruber forbundet med cybervetting jobkandidater
- Hvem malerier formidlede en moderne følelse af afvikling og isolering?
- Moderskabet driver ikke støtte til våbenkontrol


