Hvordan er elektronstrukturer af kulstof og ilt ens?
* De har begge valenselektroner i det andet energiniveau: Dette betyder, at deres yderste elektroner, der er involveret i binding, er i det samme energiniveau.
* De har begge en tendens til at danne kovalente obligationer: De opnår stabilitet ved at dele elektroner med andre atomer for at afslutte deres ydre skal. Carbon har 4 valenselektroner, så det kan danne 4 kovalente bindinger, mens ilt har 6 valenselektroner og har en tendens til at danne 2 kovalente bindinger.
Der er dog også vigtige forskelle:
* Antal valenselektroner: Carbon har 4 valenselektroner, mens ilt har 6.
* Elektronegativitet: Oxygen er mere elektronegativ end kulstof, hvilket betyder, at det tiltrækker elektroner stærkere. Denne forskel påvirker de typer bindinger, de danner, og polariteten af de molekyler, de skaber.
Sammenfattende, mens både kulstof og ilt deler karakteristikken ved at have deres valenselektroner i det andet energiniveau og danne kovalente bindinger, har de også betydelige forskelle i deres elektronkonfigurationer og elektronegativitet, hvilket fører til forskellige kemiske egenskaber.
Sidste artikelEr detergentionisk forbindelsesforbindelse eller kovalent forbindelse?
Næste artikelHvorfor er vand neutral vigtigt?
 Varme artikler
Varme artikler
-
 Farvelægning af hjerteslagHjertesygdomme er en af de førende dødsårsager rundt om i verden. At finde lette tidlige måder at screene efter gode lægemidler er afgørende. Kredit:Kyoto University iCeMS I det 17. århundrede t
Farvelægning af hjerteslagHjertesygdomme er en af de førende dødsårsager rundt om i verden. At finde lette tidlige måder at screene efter gode lægemidler er afgørende. Kredit:Kyoto University iCeMS I det 17. århundrede t -
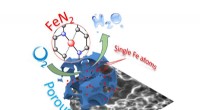 Katalysatorfremskridt kan føre til økonomiske brændselscellerSkematisk illustration af enkeltatomskatalysator forankret på porøst kulstof. Kredit:WSU Forskere ved Washington State University har udviklet en ny måde at lave billige, enkeltatoms katalysatorer
Katalysatorfremskridt kan føre til økonomiske brændselscellerSkematisk illustration af enkeltatomskatalysator forankret på porøst kulstof. Kredit:WSU Forskere ved Washington State University har udviklet en ny måde at lave billige, enkeltatoms katalysatorer -
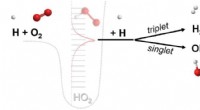 Forskere opdager en ny klasse af kemisk reaktionEn kemisk reaktion, hvor tre forskellige molekyler (fx H, O2, H) hver deltager i brydning og dannelse af kemiske bindinger. Reaktionen medieres af et flygtig kollisionskompleks (HO2**) dannet ved samm
Forskere opdager en ny klasse af kemisk reaktionEn kemisk reaktion, hvor tre forskellige molekyler (fx H, O2, H) hver deltager i brydning og dannelse af kemiske bindinger. Reaktionen medieres af et flygtig kollisionskompleks (HO2**) dannet ved samm -
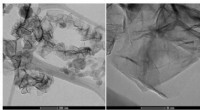 Reduktion af drivhusgasemissioner ved hjælp af mikrobølgeplasmateknologiBillederne viser nanografenmorfologien som produceret i mikrobølgeplasmaet. Nanografenet optræder her i krøllet filamentær form. Større forstørrelse viser overlappede ark og krøllede kanter. Kredit:H
Reduktion af drivhusgasemissioner ved hjælp af mikrobølgeplasmateknologiBillederne viser nanografenmorfologien som produceret i mikrobølgeplasmaet. Nanografenet optræder her i krøllet filamentær form. Større forstørrelse viser overlappede ark og krøllede kanter. Kredit:H
- Hvor møder du den ekstra ledning, når du tilslutter en 4 spids i tre udløb til tørretumbler på?…
- Syntetiske biologer hacker bakteriesensorer
- Hvilken er den eneste planet, der kredser om Sol, der ligger på sin side?
- Billede:Copernicus Sentinel-2A satellit fanger det nordlige Brasiliens Marajó-ø
- Hvilke planeter blev kun opdaget i moderne tid?
- Hvilke levende organismer bidrager til fysisk forvitring?


