Er detergentionisk forbindelsesforbindelse eller kovalent forbindelse?
Her er hvorfor:
* kovalent binding: Kernen i et vaskemiddelmolekyle er en lang carbonhydridkæde (tænk på en lang hale lavet af kulstof- og brintatomer). Disse kæder holdes sammen af stærke kovalente bindinger.
* ionisk binding: I den anden ende af detergentmolekylet er en "hoved" -gruppe. Denne hovedgruppe indeholder typisk en negativt ladet gruppe, såsom et sulfat (SO4-) eller en carboxylat (COO-) gruppe. Denne negative ladning er det, der gør detergentmolekylet ionisk.
Kombinationen af en lang, ikke -polær carbonhydridkæde og en polær, ionisk hovedgruppe er det, der giver vaskemidler deres unikke egenskaber. Den ikke -polære hale tillader vaskemidlet at opløse fedt og olie, mens det polære hoved tillader det at opløses i vand.
Eksempel: Natriumdodecylsulfat (SDS), et almindeligt vaskemiddel, har en lang carbonhydridkæde og en sulfatgruppe med en natriumion (Na+) fastgjort. Denne struktur gør SDS både ionisk og kovalent.
Sidste artikelHvad er Lewis Dot -strukturen til natriumborhydrid?
Næste artikelHvordan er elektronstrukturer af kulstof og ilt ens?
 Varme artikler
Varme artikler
-
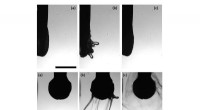 Polymerer forhindrer potentielt farlig tåge under tandlægebesøgBrug af polyakrylsyreopløsning i vand som vandingsvæske i tandplejen reducerer risikoen for aerosolformede patogener. Her, polymeren er vist og danner slangelignende tråde nær spidsen af en vibreren
Polymerer forhindrer potentielt farlig tåge under tandlægebesøgBrug af polyakrylsyreopløsning i vand som vandingsvæske i tandplejen reducerer risikoen for aerosolformede patogener. Her, polymeren er vist og danner slangelignende tråde nær spidsen af en vibreren -
 Ny forskning forklarer, hvorfor nogle molekyler har uregelmæssige formerKredit:Vanderbilt University Der er altid en grund til, hvordan molekyler dannes, og hvordan de er formet. Når først forskere forstår bindingerne i molekyler, de finder ud af måder at bruge de mat
Ny forskning forklarer, hvorfor nogle molekyler har uregelmæssige formerKredit:Vanderbilt University Der er altid en grund til, hvordan molekyler dannes, og hvordan de er formet. Når først forskere forstår bindingerne i molekyler, de finder ud af måder at bruge de mat -
 Hvad får den appalachiske trøffel til at smage og dufte lækkert?Disse appalachiske trøfler kan en dag blive lige så værdsatte som dem fra Europa. Kredit:David Fortier Et kendetegn for et virkelig luksuriøst måltid er et drys af trøffelspåner - svampetypen, ikke
Hvad får den appalachiske trøffel til at smage og dufte lækkert?Disse appalachiske trøfler kan en dag blive lige så værdsatte som dem fra Europa. Kredit:David Fortier Et kendetegn for et virkelig luksuriøst måltid er et drys af trøffelspåner - svampetypen, ikke -
 Video:Hvorfor kagedonuts og gærdonuts er så forskelligeKredit:The American Chemical Society Donuts er universelt elskede. Men der er en væsentlig sanseforskel mellem at bide i en kage-donut og at bide i en gærhævet donut. Ingredienserne er næsten ide
Video:Hvorfor kagedonuts og gærdonuts er så forskelligeKredit:The American Chemical Society Donuts er universelt elskede. Men der er en væsentlig sanseforskel mellem at bide i en kage-donut og at bide i en gærhævet donut. Ingredienserne er næsten ide
- Er dit March Madness-beslag virkelig bedre end mit?
- Over for orkanens oversvømmelser, Den amerikanske by tager lærdom af fortiden
- Hvordan tarmen fik sin villi:Ved at sammenligne arter undersøger forskere en proces, de kalder 'vil…
- Chinas BAIC tager 5% ejerandel i Daimler:tysk bilproducent
- Hvordan er det muligt at lande på månen?
- Alle ombord! Næste stop plads...


