Hvad er Lewis Dot -strukturen til natriumborhydrid?
1. Bestem det centrale atom:
* Bor (b) er det mindst elektronegative atom, så det vil være det centrale atom.
2. Tæl valenselektronerne:
* Natrium (NA) har 1 valenselektron.
* Boron (B) har 3 valenselektroner.
* Hydrogen (H) har 1 valenselektron.
* Samlet valenselektroner =1 + 3 + (4 * 1) =8
3. Tegn skeletstrukturen:
* Placer boratomet i midten.
* Tilslut de fire hydrogenatomer til boratomet.
4. Distribuer valenselektroner:
* Hvert hydrogenatom har brug for 1 elektron for at afslutte sin duet.
* Bor har brug for 8 elektroner for at afslutte sin oktet.
5. Kontroller for formelle gebyrer:
* Natrium (NA) har en +1 ladning.
* Borohydrid (BH4-) har en -1 -ladning.
Lewis Dot -strukturen for natriumborhydrid (NABH4) er:
`` `
H
|
H - b - h
|
H
Na+
`` `
Nøglepunkter:
* Boratomet har 4 enkeltbindinger til brintatomerne og afslutter sin oktet.
* Hvert hydrogenatom har en enkelt binding, der afslutter sin duet.
* Natrium vises som en separat ion med en +1 ladning.
* Borohydridion (BH4-) har en -1 -ladning.
Bemærk: Selvom dette er en almindelig repræsentation, er den faktiske struktur af natriumborhydrid mere kompleks, der involverer ioniske bindinger og interaktioner. Denne Lewis -struktur er en forenklet repræsentation for at illustrere bindings- og elektronarrangementet.
 Varme artikler
Varme artikler
-
 LSU Chemical Engineering afslører nye destillationskolonnerJohn Pendergast, professional-in-residence i Cain Department of Chemical Engineering, og John Flake, formand for Cain Department of Chemical Engineering. Kredit:LSU College of Engineering LSU Cain
LSU Chemical Engineering afslører nye destillationskolonnerJohn Pendergast, professional-in-residence i Cain Department of Chemical Engineering, og John Flake, formand for Cain Department of Chemical Engineering. Kredit:LSU College of Engineering LSU Cain -
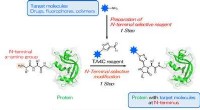 Enkel N-terminal modifikation af proteiner i et enkelt trinFig. 1. Et et-trins præparat af TA4C og en et-trins biokonjugering målrettet mod en N-terminal a-aminogruppe. Den blå stjerne repræsenterer et målmolekyle for N-terminal modifikation. Kredit:Osaka Uni
Enkel N-terminal modifikation af proteiner i et enkelt trinFig. 1. Et et-trins præparat af TA4C og en et-trins biokonjugering målrettet mod en N-terminal a-aminogruppe. Den blå stjerne repræsenterer et målmolekyle for N-terminal modifikation. Kredit:Osaka Uni -
 Innovationens søde smagKredit:CC0 Public Domain Ville den iskolde flaske sodavand smage så forfriskende, vel vidende at den indeholder 65 gram (5 spsk) tilsat sukker? Med en ny amerikansk fødevaremærkningspolitik sat i
Innovationens søde smagKredit:CC0 Public Domain Ville den iskolde flaske sodavand smage så forfriskende, vel vidende at den indeholder 65 gram (5 spsk) tilsat sukker? Med en ny amerikansk fødevaremærkningspolitik sat i -
 Nye keramiske nanofiber svampe kan bruges til fleksibel isolering, vandrensningForskere har udviklet et svampelignende materiale fremstillet af keramiske nanofibre. Materialet bevarer den varmebestandighed, der gør keramik nyttig i højtemperaturindstillinger, men er også meget d
Nye keramiske nanofiber svampe kan bruges til fleksibel isolering, vandrensningForskere har udviklet et svampelignende materiale fremstillet af keramiske nanofibre. Materialet bevarer den varmebestandighed, der gør keramik nyttig i højtemperaturindstillinger, men er også meget d
- Planeter omkring et sort hul? Beregninger viser muligheden for bizarre verdener
- Hvilket år byggede Francis Crick DNA-modellen?
- Første nogensinde atomopløsningsvideo af saltkrystaller, der dannes i realtid
- Disse 3 uhyggelige videnskabshistorier kan krybe dig ud
- Hvad er det lave sænkede overfladetræk ved månen?
- Kunne handel med egern have bidraget til Englands middelalderlige spedalskhedsudbrud?


