Hvad er elektronkonfigurationsnotation for germanium?
1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P²
Sådan bryder det ned:
* 1S²: Det første energiniveau (n =1) har 2 elektroner i S -orbitalen.
* 2s²: Det andet energiniveau (n =2) har 2 elektroner i S -orbitalen.
* 2p⁶: Det andet energiniveau (n =2) har 6 elektroner i P -orbitalen.
* 3S²: Det tredje energiniveau (n =3) har 2 elektroner i S -orbitalen.
* 3p⁶: Det tredje energiniveau (n =3) har 6 elektroner i P orbital.
* 4S²: Det fjerde energiniveau (n =4) har 2 elektroner i S -orbitalen.
* 3d¹⁰: Det tredje energiniveau (n =3) har 10 elektroner i D -orbitalen.
* 4p²: Det fjerde energiniveau (n =4) har 2 elektroner i P orbital.
Denne konfiguration afspejler den rækkefølge, i hvilken elektroner udfylder orbitaler, efter Aufbau -princippet og Hunds regel.
Sidste artikelHvad er elektronkonfigurationen for Germanium (GE)?
Næste artikelHvad er Lewis Dot -strukturen til natriumborhydrid?
 Varme artikler
Varme artikler
-
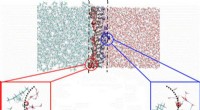 Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o
Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o -
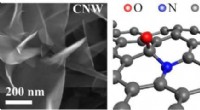 Alternativ til nitrogen:Oxygenplasma kan forbedre elektrodematerialers egenskaberSEM -billede af Carbon NanoWalls (CNW), en mulig position af ilt og nitrogen heteroatomer, cykliske voltammetri -kurver i sur elektrolyt. Kredit:Skolkovo Institute of Science and Technology En gru
Alternativ til nitrogen:Oxygenplasma kan forbedre elektrodematerialers egenskaberSEM -billede af Carbon NanoWalls (CNW), en mulig position af ilt og nitrogen heteroatomer, cykliske voltammetri -kurver i sur elektrolyt. Kredit:Skolkovo Institute of Science and Technology En gru -
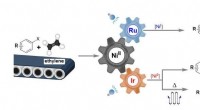 Katalytisk omdannelse af ethylenIllustration, der viser de nikkelkatalyserede reaktioner mellem kommercielt tilgængeligt arylhalogenid og ethylen. Oxidationstilstanden af nikkelkatalysatoren ændres til +1 eller 0, når den modulere
Katalytisk omdannelse af ethylenIllustration, der viser de nikkelkatalyserede reaktioner mellem kommercielt tilgængeligt arylhalogenid og ethylen. Oxidationstilstanden af nikkelkatalysatoren ændres til +1 eller 0, når den modulere -
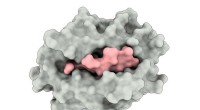 En gang nedsat bindingsmekanisme kan være nøglen til at målrette virusEn illustration viser et større histokompatibilitets (gråt) protein, der omfatter et peptid hentet fra et SARS-CoV-virus (pink). Komplekset hjælper med at udløse aktiveringen af T -celler, der er en
En gang nedsat bindingsmekanisme kan være nøglen til at målrette virusEn illustration viser et større histokompatibilitets (gråt) protein, der omfatter et peptid hentet fra et SARS-CoV-virus (pink). Komplekset hjælper med at udløse aktiveringen af T -celler, der er en
- Hvad er SI -enheden for kraft og højde arbejdsmasse energi?
- Hvilken klippe er småsten lavet af?
- Hvilken by ligger den 19. nord og 99 vest?
- Er den indre kerne af jorden ekstremt varm og er sandsynligvis solid?
- Hvad er de 5 største konstellationer?
- Forskere lærer mere om, hvordan motorer manøvrerer vores cellers veje


