Hvad er elektronkonfigurationen for Germanium (GE)?
1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P²
Her er en sammenbrud:
* 1S²: Det første energiniveau (n =1) har 2 elektroner i S -orbitalen.
* 2s²: Det andet energiniveau (n =2) har 2 elektroner i S -orbitalen.
* 2p⁶: Det andet energiniveau har også 6 elektroner i P orbital.
* 3S²: Det tredje energiniveau (n =3) har 2 elektroner i S -orbitalen.
* 3p⁶: Det tredje energiniveau har også 6 elektroner i P orbital.
* 4S²: Det fjerde energiniveau (n =4) har 2 elektroner i S -orbitalen.
* 3d¹⁰: Det tredje energiniveau har også 10 elektroner i D Orbital.
* 4p²: Det fjerde energiniveau har også 2 elektroner i P orbital.
Vigtig note: Elektronkonfigurationen afspejler påfyldningen af orbitaler på en måde, der prioriterer lavere energiniveau, men der er nogle undtagelser fra denne regel. Denne konfiguration er den mest stabile og energisk gunstige for germanium.
Sidste artikelHvor mange kerneelektroner er der i germanium?
Næste artikelHvad er elektronkonfigurationsnotation for germanium?
 Varme artikler
Varme artikler
-
 En strandelskers drøm:Et skridt mod langtidsholdbar solcremeKredit:Marina Shemesh/offentligt domæne I en perfekt verden, folk ville flittigt genanvende solskærmen hvert par timer for at beskytte deres sarte hud mod skadelig solstråling. Men i virkeligheden
En strandelskers drøm:Et skridt mod langtidsholdbar solcremeKredit:Marina Shemesh/offentligt domæne I en perfekt verden, folk ville flittigt genanvende solskærmen hvert par timer for at beskytte deres sarte hud mod skadelig solstråling. Men i virkeligheden -
 Kemiske biologer afdækker årsagen til en sjælden hjernesygdommaj Khanna, PhD, venstre, bruger 3D-briller til at hjælpe med at visualisere et molekyle skabt i hendes laboratorium. Kredit:Nadia Whitehead / UA College of Medicine -Tucson Babyer født med pontoc
Kemiske biologer afdækker årsagen til en sjælden hjernesygdommaj Khanna, PhD, venstre, bruger 3D-briller til at hjælpe med at visualisere et molekyle skabt i hendes laboratorium. Kredit:Nadia Whitehead / UA College of Medicine -Tucson Babyer født med pontoc -
 Ny lim klæber nemt, holder stærkt, og er en gas at trække fra hinandenEt midlertidigt klæbemiddel baseret på molekylære faste stoffer er stærkt nok til at holde en kemi-ph.d.-kandidat, men kan frigives uden kraft ved brug af varme i et vakuum. Kredit:Nicholas Blloch
Ny lim klæber nemt, holder stærkt, og er en gas at trække fra hinandenEt midlertidigt klæbemiddel baseret på molekylære faste stoffer er stærkt nok til at holde en kemi-ph.d.-kandidat, men kan frigives uden kraft ved brug af varme i et vakuum. Kredit:Nicholas Blloch -
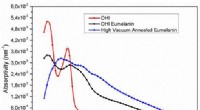 Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte
Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte
- Forældre med lav indkomst ønsker et hvidt stakit, ikke kun penge, før man bliver gift
- Små lasere, der fungerer sammen som en:Topologiske laserarrays med lodrette hulrum
- Videnskaben lider sideløbende skade, da USA, Kinas spændinger stiger
- Børn negativt påvirket af restriktioner for tidlig indsats
- Hvis sekvensen af nukleotider på en streng er et DNA -molekyle, er Gccattg -komplement?
- Kombination af varmere vand, kemisk eksponering forstærker skadelige virkninger hos en kystfisk


