Er Zn5i31 en gyldig kemisk formel?
* ioniske forbindelser: Zink (Zn) er et metal, og jod (I) er en ikke -metal. Dette indikerer en ionisk forbindelse, hvor metallet mister elektroner til at blive en kation (Zn²⁺) og de ikke -metale vinder elektroner til at blive en anion (i⁻).
* opladningsbalance: Afgifterne for ionerne skal afbalancere for at danne en neutral forbindelse. Den mest almindelige ioniske form for zink er Zn²⁺, og jod danner typisk anionen I⁻.
* Find den korrekte formel: For at finde den korrekte formel skal du bestemme det mindste forhold mellem hele nummeret mellem ioner, der resulterer i en neutral forbindelse. Da Zn²⁺ har en +2 ladning og i⁻ har en -1 -ladning, har vi brug for 2 iodioner (2 x -1 =-2) for at afbalancere +2 -ladningen af zink. Derfor er den korrekte formel for zinkiodid zni₂ .
Key Takeaway: Kemiske formler skal repræsentere det korrekte forhold mellem atomer eller ioner for at sikre ladningsneutralitet i forbindelsen.
 Varme artikler
Varme artikler
-
 En ny klasse af membraner lover interessante anvendelser inden for materialeadskillelseDen nye klasse af membraner kunne med succes bruges til adskillelse. Kredit:Forfattere af undersøgelsen En ny klasse af membraner lover meget interessante anvendelser inden for materialeadskillels
En ny klasse af membraner lover interessante anvendelser inden for materialeadskillelseDen nye klasse af membraner kunne med succes bruges til adskillelse. Kredit:Forfattere af undersøgelsen En ny klasse af membraner lover meget interessante anvendelser inden for materialeadskillels -
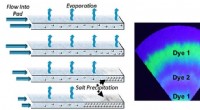 Papirbaseret enhed giver lavt strømforbrug, langsigtet metode til at analysere svedFordampningen af sved på papirpuder kunne bruges til væsketransport i wearables over lange perioder. Det resulterende tørre lag af kagede salte ville bevare en tidsstemplet registrering af biomarkør
Papirbaseret enhed giver lavt strømforbrug, langsigtet metode til at analysere svedFordampningen af sved på papirpuder kunne bruges til væsketransport i wearables over lange perioder. Det resulterende tørre lag af kagede salte ville bevare en tidsstemplet registrering af biomarkør -
 Hvordan påvirker strømning kræfter af ladede overflader/partikler og overfladeaktive stoffer i væ…Væskestrøm muliggør mere adsorption. Kredit:© 2020 American Chemical Society Du er på kontoret. Du har skrevet en rapport og trykket på Udskriv. Gå hen til printeren og hent den friske, inkjet-try
Hvordan påvirker strømning kræfter af ladede overflader/partikler og overfladeaktive stoffer i væ…Væskestrøm muliggør mere adsorption. Kredit:© 2020 American Chemical Society Du er på kontoret. Du har skrevet en rapport og trykket på Udskriv. Gå hen til printeren og hent den friske, inkjet-try -
 Ny forskning kan hjælpe renere energiteknologierGuangwen Zhou er professor i maskinteknik ved Binghamton University, State University of New York. Kredit:Binghamton University, State University of New York Ny forskning ledet af fakultetet ved B
Ny forskning kan hjælpe renere energiteknologierGuangwen Zhou er professor i maskinteknik ved Binghamton University, State University of New York. Kredit:Binghamton University, State University of New York Ny forskning ledet af fakultetet ved B
- Hvorfor eksperimenterer vi med mus?
- Rejsende med handicap møder ofte diskrimination:Hvad bør ændres, og hvordan man klager
- Hvordan man opnår højkrystallinske organisk-uorganiske perovskitfilm til solceller
- Hvad er trykcyklus?
- Har alle ikke -metaller en totalfuld valensskal af elektroner?
- Hvilken konstellation passerer Jupiter ikke igennem?


