Hvorfor er vandmolekyle polar?
1. ulig deling af elektroner (polære kovalente bindinger): Oxygenatomet i vand er mere elektronegativ end hydrogenatomerne. Dette betyder, at ilt tiltrækker de delte elektroner i de kovalente bindinger stærkere, hvilket skaber en delvis negativ ladning (Δ-) på iltatomet og delvis positive ladninger (δ+) på hydrogenatomerne.
2. bøjet molekylær geometri: Vandmolekylet har en bøjet eller V-formet geometri på grund af tilstedeværelsen af to ensomme par elektroner på iltatomet. Denne form sikrer, at de delvise positive ladninger af hydrogenatomerne er på den ene side af molekylet, og den delvise negative ladning af iltatomet er på den modsatte side, hvilket skaber et dipolmoment.
3. resulterende dipolmoment: Den ujævne fordeling af ladninger skaber et netto dipolmoment, hvilket betyder, at molekylet har en positiv og negativ ende, hvilket gør det polært. Dette dipolmoment er ansvarlig for mange af vandets unikke egenskaber, såsom dets høje kogepunkt, evne til at opløse mange stoffer og dets rolle som opløsningsmiddel i biologiske systemer.
Kortfattet: Kombinationen af polære kovalente bindinger og bøjede molekylære geometri resulterer i en ujævn fordeling af ladninger inden for vandmolekylet, hvilket gør det til et polært molekyle.
Sidste artikelEr Zn5i31 en gyldig kemisk formel?
Næste artikelHvad er strukturen af atomer?
 Varme artikler
Varme artikler
-
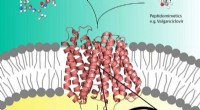 Røntgenbilleder afslører layout af lastet lægemiddeltransportørPro-lægemidler som Valganciclovir (øverst til højre) kan bruge peptidtransportøren (i midten) i cellemembranen, der normalt transporterer næringsstofpeptider (øverst til venstre) ind i cellen. Kredit:
Røntgenbilleder afslører layout af lastet lægemiddeltransportørPro-lægemidler som Valganciclovir (øverst til højre) kan bruge peptidtransportøren (i midten) i cellemembranen, der normalt transporterer næringsstofpeptider (øverst til venstre) ind i cellen. Kredit: -
 Illinois forskeres teori om pore-skala transport for at muliggøre forbedret flow batterierAdjunkt Kyle Smith. Kredit:L. Brian Stauffer. Redox-flow-batterier er en ny teknologi til elektrokemisk energilagring, der kan hjælpe med at øge brugen af strøm produceret af vedvarende energire
Illinois forskeres teori om pore-skala transport for at muliggøre forbedret flow batterierAdjunkt Kyle Smith. Kredit:L. Brian Stauffer. Redox-flow-batterier er en ny teknologi til elektrokemisk energilagring, der kan hjælpe med at øge brugen af strøm produceret af vedvarende energire -
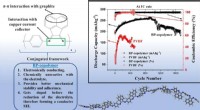 Nyt copolymerbindemiddel for at forlænge levetiden af lithium-ion-batterierNyt copolymerbindemiddel til grafitanode på Li-ion-batterier. BP-copolymeren byder på flere fordele, der sætter den milevidt foran det konventionelle PVDF-bindemiddel med hensyn til stabilitet og hold
Nyt copolymerbindemiddel for at forlænge levetiden af lithium-ion-batterierNyt copolymerbindemiddel til grafitanode på Li-ion-batterier. BP-copolymeren byder på flere fordele, der sætter den milevidt foran det konventionelle PVDF-bindemiddel med hensyn til stabilitet og hold -
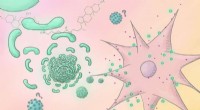 Vaccineingredienser kan gemme sig i små molekylebibliotekerForskerne fandt et molekyle, der kan bruges som vaccineadjuvans og styrker immunresponset, når det tilsættes en vaccine. Kredit:Mindy Takamiya/Kyoto University iCeMS Mange vacciner indeholder ingr
Vaccineingredienser kan gemme sig i små molekylebibliotekerForskerne fandt et molekyle, der kan bruges som vaccineadjuvans og styrker immunresponset, når det tilsættes en vaccine. Kredit:Mindy Takamiya/Kyoto University iCeMS Mange vacciner indeholder ingr
- Hvordan passer egern sammen?
- Var i en æra med overtourisme, men der er en mere bæredygtig vej frem
- Hvilken type reaktion bruger brintbomben?
- Hvad er forskellen mellem et aldehydsukker og et ketonsukker?
- Kommentar:Facebook har netop opgivet kampen mod falske nyheder
- Forskere beskriver en ny strålescanningsenhed, der bruger fotoniske krystaller


