Røntgenbilleder afslører layout af lastet lægemiddeltransportør
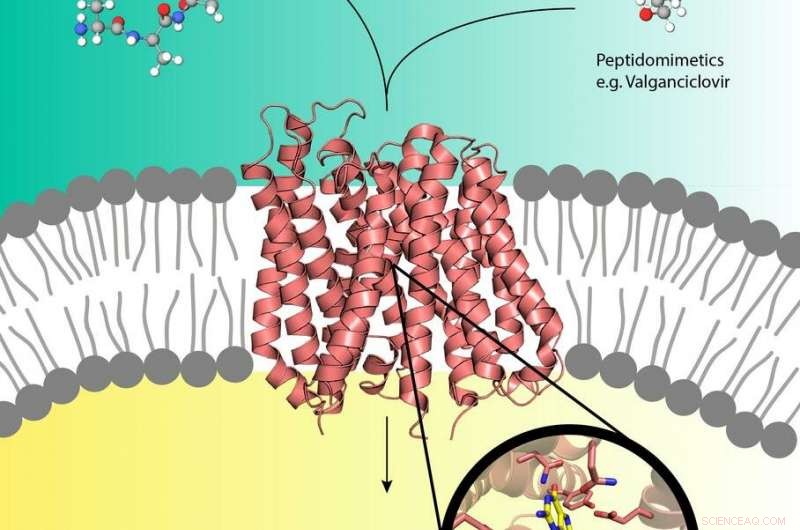
Pro-lægemidler som Valganciclovir (øverst til højre) kan bruge peptidtransportøren (i midten) i cellemembranen, der normalt transporterer næringsstofpeptider (øverst til venstre) ind i cellen. Kredit:EMBL, Yonca Ural-Blimke
Eksperimenter med DESYs røntgenkilde PETRA III har afsløret den første struktur af et biologisk transportprotein fyldt med et pro-lægemiddel. Prolægemidler er inaktive lægemidler, der metaboliseres til en aktiv, funktionel form i kroppen. De kan kapre de menneskelige næringsstoftransportørproteiner PepT1 eller PepT2, der er placeret i cellemembranen og normalt kanaliserer peptider, der stammer fra fordøjet mad, til celler. Denne måde, pro-drugs kan køre en tur direkte ind i cellen, fremskynde lægemidlets absorption. Selvom lægemiddelkonceptet er meget effektivt, lidt er kendt på molekylært niveau om peptidtransporternes struktur og hvordan de genkender, binde og transportere lægemidler. Grupperne af Christian Loew og Jan Kosinski fra European Molecular Biology Laboratory (EMBL), der arbejder på Center for Structural Systems Biology (CSSB) på DESY campus i Hamburg, er nu et skridt tættere på at forstå dette.
Forskerne bestemte den første højopløselige krystalstruktur af en peptidtransportør i kompleks med den farmakologiske relevante pro-lægemiddel valganciclovir; en medicin, der bekæmper visse virusinfektioner. Deres resultater, offentliggjort i Journal of the American Chemical Society , kunne hjælpe med design af pro-lægemidler med forbedrede absorptionshastigheder. CSSB er et samarbejde mellem ti videnskabelige institutioner, herunder DESY.
Den bakterielle peptidtransportør DtpA fra Escherichia coli er en tæt homolog for den menneskelige PepT1 -transportør og blev derfor valgt af forskerne som en prototype. Den biomolekyles rumlige struktur kan bestemmes ved at dyrke bittesmå krystaller fra mange af de samme biomolekyler og belyse dem med røntgen. Krystallerne diffrakterer røntgenstrålerne på en måde, der er relateret til deres indre struktur. Det betyder, fra diffraktionsmønsteret, krystallens indre struktur kan beregnes, afsløre atomstrukturen i dets bestanddele, biomolekylerne.
Dyrkning af krystaller af tilstrækkelig høj kvalitet fra biomolekyler kan være meget udfordrende. For at producere veldiffrakterende krystaller af DtpA, Loew slog sig sammen med gruppen af Jan Steyaert fra Vrije Universiteit i Bruxelles for at generere DtpA -specifikke nanobodies. Nanobodies er specifikke enkelt-domæne antistoffragmenter. "De øger stabiliteten af membranproteiner som DtpA og giver os dermed mulighed for at generere krystaller af høj kvalitet, "forklarer Loew.
Loew-gruppen udførte derefter krystallisationsforsøgene af DtpA i kompleks med en nanobody og et pro-drug-molekyle på prøveforberedelses- og karakteriseringsfaciliteten (SPC) og analyserede de opnåede krystaller ved beamlines P13 og P14, som er en del af DESYs X- stråle lyskilde PETRA III og drives af t EMBL. Forskerne var i stand til at bestemme en 2,65 Ångstrom (0,265 nano meter) opløsningsstruktur for DtpA bundet til det pro-lægemiddel valganciclovir, der afslørede en uventet bindingstilstand. "Orienteringen af lægemidlet i bindingslommen vendes 180 grader i forhold til tidligere forudsigelser, "forklarer Loew." Vi opdagede også, at DtpA fortrinsvis binder og sandsynligvis transporterer tripeptider frem for dipeptider. "
Kosinski-gruppen byggede en strukturel model af høj kvalitet af den menneskelige PepT1-transportør i kompleks med valganciclovir ved hjælp af DtpA-krystalstrukturen som en vejledning. "Modellen viser, at humant PepT1 meget sandsynligt binder lægemidlet på samme måde som DtpA og præciserer de nøjagtige aminosyregrupper, der er ansvarlige for binding, "præciserer Kosinski. Derfor, den indsigt, der genereres af denne model af PepT1, kan lette udviklingen af nye pro-lægemidler med forbedrede absorptionshastigheder. Sådanne forbedringer ville ikke kun sænke den farmakologisk effektive dosis, men kunne også reducere de negative bivirkninger, som patienterne oplevede.
 Varme artikler
Varme artikler
-
 Bioinspirerede materialer-lån fra naturens legebogEt skibsskelet af havsvamp, der viser den komplekse karakter af dets struktur, som giver fantastisk styrke. Kredit:Michael Monn, Kesari Lab, Brown University Naturen giver utallige eksempler på un
Bioinspirerede materialer-lån fra naturens legebogEt skibsskelet af havsvamp, der viser den komplekse karakter af dets struktur, som giver fantastisk styrke. Kredit:Michael Monn, Kesari Lab, Brown University Naturen giver utallige eksempler på un -
 Maskinlæringsalgoritme hjælper med at søge efter nye lægemidlerKredit:CC0 Public Domain Forskere har designet en maskinlæringsalgoritme til lægemiddelopdagelse, som har vist sig at være dobbelt så effektiv som industristandarden, som kunne fremskynde processe
Maskinlæringsalgoritme hjælper med at søge efter nye lægemidlerKredit:CC0 Public Domain Forskere har designet en maskinlæringsalgoritme til lægemiddelopdagelse, som har vist sig at være dobbelt så effektiv som industristandarden, som kunne fremskynde processe -
 Forskere udvikler molekylært termometer til kontaktløs måling ved hjælp af infrarødt lysDen molekylære rubin i fast (rød) og opløst (gul) tilstand kan bruges til kontaktløs måling af temperatur. Kredit:Sven Otto, JGU Kemikere ved Johannes Gutenberg University Mainz (JGU) har i samarb
Forskere udvikler molekylært termometer til kontaktløs måling ved hjælp af infrarødt lysDen molekylære rubin i fast (rød) og opløst (gul) tilstand kan bruges til kontaktløs måling af temperatur. Kredit:Sven Otto, JGU Kemikere ved Johannes Gutenberg University Mainz (JGU) har i samarb -
 Bouncende bobler ryster emulsionsundersøgelserHøjhastighedskamera snapshots og simuleringer af bobler, der hopper fra vand-luft-grænseflader, kan bruges til at detektere spormængder af forurenende stoffer. Kredit:Ivan Vakarelski Nogle af de h
Bouncende bobler ryster emulsionsundersøgelserHøjhastighedskamera snapshots og simuleringer af bobler, der hopper fra vand-luft-grænseflader, kan bruges til at detektere spormængder af forurenende stoffer. Kredit:Ivan Vakarelski Nogle af de h
- Bedre forståelse af hydrogenperoxidregulering kan føre til ny indsigt i sygdomsudvikling
- Blændende spiral med et aktivt hjerte
- Kaffemaskine hjælper fysikere med at lave mere effektive ionfælder
- Er ligestilling på arbejdspladsen økonomiens skjulte motor?
- Konkurrencedygtig rivalisering inden for Facebook-beskeder er ikke så dårlig
- Hvad er uendelig i matematik?


