Har alle ikke -metaller en totalfuld valensskal af elektroner?
Her er hvorfor:
* Valence Shell: Dette er den yderste skal af elektroner i et atom. Det er skallen involveret i kemisk binding.
* ikke -metaller: Disse elementer får typisk elektroner for at opnå en fuld valensskal. De findes på højre side af den periodiske tabel (undtagen brint).
Eksempler:
* nitrogen (n): Har 5 valenselektroner og har brug for 3 mere for at fylde sin skal.
* ilt (O): Har 6 valenselektroner og har brug for 2 mere for at fylde sin skal.
* klor (Cl): Har 7 valenselektroner og har brug for 1 mere for at fylde sin skal.
Undtagelser:
* gruppe 18 (ædelgasser): Disse elementer har en fuld valensskal pr. Definition. De er usædvanligt ureaktive, fordi de ikke behøver at vinde eller miste elektroner.
* Nogle ikke -metaller i gruppe 17 (halogener) og gruppe 16 (chalcogens): Kan danne kovalente bindinger ved at dele elektroner, hvilket kan føre til en situation, hvor de ikke har en helt fuld valensskal.
Nøglepunkter:
* Ikke -metaller har en tendens til at få elektroner for at opnå en stabil, fuld valensskal.
* Målet er at opnå elektronkonfigurationen af en ædel gas.
* Nogle ikke -metaller kan danne kovalente bindinger og dele elektroner, som kan forlade deres valensskal delvis fyldt.
 Varme artikler
Varme artikler
-
 Forskere har syntetiseret ny flydende-krystallinsk fotokromLCD-tekstur observeret i et polarisationsoptisk mikroskop. Kredit:Alexey Bobrovsky Kemikere ved Lomonosov Moscow State University, i samarbejde med tjekkiske partnere, har syntetiseret og studeret
Forskere har syntetiseret ny flydende-krystallinsk fotokromLCD-tekstur observeret i et polarisationsoptisk mikroskop. Kredit:Alexey Bobrovsky Kemikere ved Lomonosov Moscow State University, i samarbejde med tjekkiske partnere, har syntetiseret og studeret -
 Optimering af brugen af rengøringsteknologierPlacering af fuld kegle dyser i et CAD miljø. Kredit:Fraunhofer-Gesellschaft Vi kender det fra vores eget hjem:omfangsrige køkkenredskaber og hvidevarer er svære at rengøre. I industrien, kompleks
Optimering af brugen af rengøringsteknologierPlacering af fuld kegle dyser i et CAD miljø. Kredit:Fraunhofer-Gesellschaft Vi kender det fra vores eget hjem:omfangsrige køkkenredskaber og hvidevarer er svære at rengøre. I industrien, kompleks -
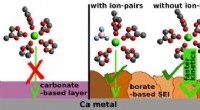 Boratbaserede passiveringslag muliggør reversible calciumbatterierFigur 1:(Venstre) Karbonatbaseret passiveringslag (dannet i Ca(TFSI) 2 baseret elektrolyt) tillader ikke plettering/stripping af calcium. (Højre) Boreret-baseret passiveringslag (dannet i Ca(BF 4
Boratbaserede passiveringslag muliggør reversible calciumbatterierFigur 1:(Venstre) Karbonatbaseret passiveringslag (dannet i Ca(TFSI) 2 baseret elektrolyt) tillader ikke plettering/stripping af calcium. (Højre) Boreret-baseret passiveringslag (dannet i Ca(BF 4 -
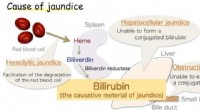 Forskere får gennembrud i antioxidantenzym forbundet med gulsotFig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der
Forskere får gennembrud i antioxidantenzym forbundet med gulsotFig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der
- Indiske redningsmænd jagter efter overlevende, mens monsunafgiften rammer 115
- Forskellen mellem Vejr og Erosion
- En model trænet til at forudsige spektroskopiske profiler hjælper med at tyde strukturen af mate…
- Hvad er en tankmotor,
- Hvad er den kemiske formel for cayennepeber?
- Hvad er forskellen i energibehov mellem mand og kvinde?


