Hvorfor SF6 er ureaktiv over for vand, men TEF6 reagerer?
Faktorer for reaktivitet:
* størrelse og elektronegativitet: Størrelsen og elektronegativiteten af det centrale atom og fluoratomerne spiller afgørende roller.
* obligationsstyrke: Styrken af S-F- og TE-F-obligationerne er en nøglefaktor.
* sterisk hindring: Det rumlige arrangement af fluoratomer omkring det centrale atom kan påvirke tilgængeligheden for vandmolekyler.
hvorfor SF6 er ureaktiv:
1. Stærke S-F-obligationer: S-F-obligationerne i SF6 er usædvanligt stærke. Svovl, der er mindre end Tellurium, danner kortere og stærkere bindinger med fluor. Denne energi med høj binding gør det vanskeligt at bryde bindingerne og lade vand reagere.
2. høj elektronegativitet af fluor: Fluor er det mest elektronegative element. Dette skaber en meget polær S-F-binding, men den symmetriske octahedrale struktur af SF6 betyder, at dipolmomenterne annullerer, hvilket resulterer i et ikke-polært molekyle generelt. Dette reducerer dens reaktivitet yderligere.
3. sterisk hindring: De seks fluoratomer i SF6 skaber en beskyttende skal omkring svovlatomet. Denne steriske hindring gør det fysisk vanskeligt for vandmolekyler at nærme sig svovlatomet og reagere.
Hvorfor TEF6 er reaktiv:
1. svagere TE-F-obligationer: Tellurium er større end svovl, hvilket fører til længere og svagere TE-F-bindinger. Dette gør dem mere modtagelige for angreb af vandmolekyler.
2. lavere elektronegativitet af Tellurium: Telluriums lavere elektronegativitet resulterer i mindre polære TE-F-bindinger sammenlignet med S-F-bindinger. Dette gør Tellurium -atomet mere modtageligt for nukleofilt angreb fra iltatomet af vand.
3. mindre sterisk hindring: Mens TEF6 også har en octahedral struktur, giver den større størrelse af Tellurium mindre sterisk hindring, hvilket gør det lettere for vandmolekyler at nærme sig og interagere med Tellurium -atomet.
Reaktion med vand:
* tef6 + H2O → TEO2 + HF (Denne reaktion er langsom, men forekommer ved stuetemperatur)
Sammenfattende gør SF6s høje bindingsstyrke, ikke-polaritet og sterisk hindring det usædvanligt modstandsdygtigt over for hydrolyse ved vand. Tef6 har på den anden side svagere bånd, et mere polært miljø og mindre sterisk hindring, hvilket gør det mere modtageligt for angreb af vand.
 Varme artikler
Varme artikler
-
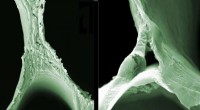 Generering af elektricitet gennem gulvoverfladerScanning elektronmikroskopi (SEM) billeder af balsa træ (venstre) og delignificeret træ illustrerer de strukturelle ændringer. Kredit:ACS Nano / Empa Ingo Burgert og hans team hos Empa og ETH Züri
Generering af elektricitet gennem gulvoverfladerScanning elektronmikroskopi (SEM) billeder af balsa træ (venstre) og delignificeret træ illustrerer de strukturelle ændringer. Kredit:ACS Nano / Empa Ingo Burgert og hans team hos Empa og ETH Züri -
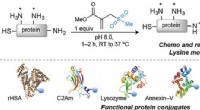 Sådan udløser en kemisk kædereaktionSkræddersyede proteinlægemidler i kampen mod kræft og andre sygdomme er et skridt tæt på, med Center for NanoScale Science and Technology på Flinders, der spiller en rolle i en af de nyeste kemifund
Sådan udløser en kemisk kædereaktionSkræddersyede proteinlægemidler i kampen mod kræft og andre sygdomme er et skridt tæt på, med Center for NanoScale Science and Technology på Flinders, der spiller en rolle i en af de nyeste kemifund -
 Video:Coronavirus-vaccine:Hvor er vi, og hvad er det næste?Kredit:The American Chemical Society Du har måske hørt, at COVID-19-vaccineforsøg er i gang i Seattle. Hvad er det præcist, der testes? Hvor meget længere vil disse test tage? Og hvornår kan vi f
Video:Coronavirus-vaccine:Hvor er vi, og hvad er det næste?Kredit:The American Chemical Society Du har måske hørt, at COVID-19-vaccineforsøg er i gang i Seattle. Hvad er det præcist, der testes? Hvor meget længere vil disse test tage? Og hvornår kan vi f -
 Billigere brintproduktionKredit:Angewandte Chemie Elektrolytisk brintproduktion drevet af vedvarende energi ses som et miljøvenligt middel til at afhjælpe globale klima- og energiproblemer. I journalen Angewandte Chemie
Billigere brintproduktionKredit:Angewandte Chemie Elektrolytisk brintproduktion drevet af vedvarende energi ses som et miljøvenligt middel til at afhjælpe globale klima- og energiproblemer. I journalen Angewandte Chemie
- Forskere rapporterer om ny platform for stereokontrol
- Forskere først til at forbinde silicium atomer på overflader
- Hvor behandles nuklear brændstof?
- En metode til at rette buet rum-tid
- Gigantisk hulrum i rummet kaster nyt lys over, hvordan stjerner dannes
- Uden Jobs skal Apple vise, at det stadig kan levere


