Hvad er ordet ligning for brændende nitrogen?
Her er hvorfor:
* forbrænding: Involverer normalt en hurtig reaktion mellem et stof og en oxidant (normalt ilt), der producerer varme og lys.
* nitrogens reaktivitet: Nitrogen er et meget stabilt molekyle med en stærk tredobbelt binding mellem nitrogenatomerne. Dette gør det vanskeligt at gå i stykker og reagere med andre stoffer, endda ilt.
I stedet for at brænde, kan nitrogen gennemgå disse reaktioner:
* reaktioner med høj temperatur: Ved ekstremt høje temperaturer, ligesom dem, der findes i lynnedslag eller forbrændingsmotorer, kan nitrogen reagere med ilt for at danne nitrogenoxider (NOX).
* nitrogenfiksering: Visse bakterier kan omdanne atmosfærisk nitrogengas til anvendelige former som ammoniak (NH3). Dette er afgørende for livet, da det er kilden til nitrogen, der bruges af planter.
Derfor er der ingen simpel ordligning for "brændende nitrogen", da det ikke opfører sig som typiske brændbare materialer.
 Varme artikler
Varme artikler
-
 Overlegen brintkatalysator vokser bare på den mådeDisse uorganiske blomster, farve tilføjet, blev skabt af Sandia National Laboratories-forsker Stanley Chou og University of California, Merced kollega Vincent Tung i en spray-print proces, der bruger
Overlegen brintkatalysator vokser bare på den mådeDisse uorganiske blomster, farve tilføjet, blev skabt af Sandia National Laboratories-forsker Stanley Chou og University of California, Merced kollega Vincent Tung i en spray-print proces, der bruger -
 Minitraktorbjælker hjælper med at arrangere kunstige celler i vævsstrukturerKunstige celler (billede i falske farver) i en række strukturer. Kredit:Imperial College London Forskere har brugt lasere til at forbinde, arrangere og flette kunstige celler, baner vejen for netv
Minitraktorbjælker hjælper med at arrangere kunstige celler i vævsstrukturerKunstige celler (billede i falske farver) i en række strukturer. Kredit:Imperial College London Forskere har brugt lasere til at forbinde, arrangere og flette kunstige celler, baner vejen for netv -
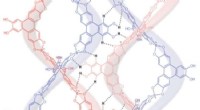 Forskere konstruerer den første syntetiske DNA-lignende polymer nogensindeDannelse af par af sammenflettede spiralformede tråde gennem en række hydrogenbindingsinteraktioner langs a-aksen. Den nærmeste interstreng-afstand inden for et par blev målt fra Ar–H til H–Ar (6,5 Å)
Forskere konstruerer den første syntetiske DNA-lignende polymer nogensindeDannelse af par af sammenflettede spiralformede tråde gennem en række hydrogenbindingsinteraktioner langs a-aksen. Den nærmeste interstreng-afstand inden for et par blev målt fra Ar–H til H–Ar (6,5 Å) -
 Meget effektiv hydrogengasproduktion ved hjælp af sollys, vand og hæmatitMesokrystal fotoanoddannelse og fotokemiske vandopdelingskarakteristika. en. Elektronmikroskopbillede af en hæmatit mesokrystal (samlet fra små nano-partikler på ca. 5 nm). b. Gasproduktion fra anoden
Meget effektiv hydrogengasproduktion ved hjælp af sollys, vand og hæmatitMesokrystal fotoanoddannelse og fotokemiske vandopdelingskarakteristika. en. Elektronmikroskopbillede af en hæmatit mesokrystal (samlet fra små nano-partikler på ca. 5 nm). b. Gasproduktion fra anoden
- Hvad er atomsymbolet for hydrogenperoxid?
- Undersøgelse afslører en ny ensartet belægningsproces af p-ALD
- Hvor er lanthanum på det periodiske tabel?
- Hvad er den intermolekylære binding af methanol?
- De kolde øjne på DUNE:International Deep Underground Neutrino Experiment
- Æble, Qualcomm bilægger bitter strid om iPhone -teknologi


