Hvad sker der med elementært kobber, når det mister to elektroner?
* Kobberens elektroniske konfiguration: Kobber har et atomnummer på 29, hvilket betyder, at det har 29 elektroner. Dens elektroniske konfiguration er [AR] 3D¹⁰ 4S¹. Dette betyder, at det har en elektron i sin yderste skal (4S).
* taber elektroner: Når kobber mister to elektroner, mister det den ene elektron fra sin 4s orbital og en elektron fra sin 3D -orbital.
* Dannelse af cu²⁺: Tabet af to elektroner efterlader kobber med en +2 ladning, hvilket resulterer i kobber (II) ion (Cu²⁺). Denne ion er nu stabil med et fuldt 3D -underskal.
Bemærk: Kobber kan også miste et elektron til dannelse af kobber (i) ion (Cu⁺), men dette er mindre almindeligt.
 Varme artikler
Varme artikler
-
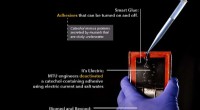 Ingeniører zapper og løsner smart undervandslimTænd og sluk for vedhæftning er det, der gør en lim smart. Det er én ting at gøre dette i det fri og noget helt andet under vand. Inspireret af naturen, katekoler er syntetiske forbindelser, der efter
Ingeniører zapper og løsner smart undervandslimTænd og sluk for vedhæftning er det, der gør en lim smart. Det er én ting at gøre dette i det fri og noget helt andet under vand. Inspireret af naturen, katekoler er syntetiske forbindelser, der efter -
 Forskere får kontrol over den interne struktur af selvsamlede kompositmaterialerEn model, der viser, hvordan et enkelt lagdelt materiale, afbildet i orange og blå, omdannes til et komplekst arkimedisk struktureret kompositmateriale, når det fryser rundt om en skabelon, afbildet i
Forskere får kontrol over den interne struktur af selvsamlede kompositmaterialerEn model, der viser, hvordan et enkelt lagdelt materiale, afbildet i orange og blå, omdannes til et komplekst arkimedisk struktureret kompositmateriale, når det fryser rundt om en skabelon, afbildet i -
 Nye bæredygtige pulpteknologierKredit:Alberto Masnovo, Shutterstock Visionen for papirmasse- og papirindustrien er at reducere udledningen af kuldioxid markant og samtidig forbedre energi- og ressourceeffektiviteten. Derfor,
Nye bæredygtige pulpteknologierKredit:Alberto Masnovo, Shutterstock Visionen for papirmasse- og papirindustrien er at reducere udledningen af kuldioxid markant og samtidig forbedre energi- og ressourceeffektiviteten. Derfor, -
 Påvisning af fortyndhed:Nye eksperimentelle og teoretiske tilgange dykker ned i puljen af membran…Ingeniører ved Washington University i St. Louis og Princeton University udviklede en ny måde at dykke ned i cellens mindste og vigtigste komponenter. Hvad de fandt inde i membranløse organeller overr
Påvisning af fortyndhed:Nye eksperimentelle og teoretiske tilgange dykker ned i puljen af membran…Ingeniører ved Washington University i St. Louis og Princeton University udviklede en ny måde at dykke ned i cellens mindste og vigtigste komponenter. Hvad de fandt inde i membranløse organeller overr
- Oversættelse fra kinesisk til engelsk:Ikke menneske, men enestående
- De første globale kort over vulkanske emissioner bruger NASA -satellitdata
- Hvilken retning er Orion konstellationen ansigt Idaho?
- Sådan beregnes fasevinkler
- Hvorfor fortsætter du med at bruge fossile brændstoffer i stedet for vedvarende ressourcer?
- Er de fleste stjerner på himlen varme eller seje?


