Hvad orbital udfyldes, når fluor accepterer en elektron fra natrium?
Her er hvorfor:
* fluorens elektronkonfiguration: Fluor har 9 elektroner med konfigurationen 1S² 2S² 2P⁵. Dette betyder, at det har 5 elektroner i sit 2P -underskal, som kan indeholde maksimalt 6 elektroner.
* natriums elektronkonfiguration: Natrium har 11 elektroner med konfigurationen 1S² 2S² 2p⁶ 3S¹. Det har et enkelt elektron i sin 3'ere orbital, som er længere væk fra kernen og har et højere energiniveau end 2p -orbitaler.
* ionisk binding: Når natrium mister sin 3S -elektron til fluor, bliver det en positivt ladet ion (Na⁺). Fluor får denne elektron, afslutter sit 2p -underskal og bliver en negativt ladet ion (F⁻). Denne overførsel af elektroner danner en ionisk binding mellem de to atomer.
Derfor udfyldes 2p -orbitalen af fluor, når det accepterer et elektron fra natrium.
Sidste artikelHvis et stof har pH på 1, er det stærkt eller svagt syre?
Næste artikelHvornår kondenseres vand?
 Varme artikler
Varme artikler
-
 Video:Gallium og historien om det periodiske systemKredit:The American Chemical Society Nogle kemikere ser måske det periodiske system med elementer som et helligt vidnesbyrd om videnskabens magt. Imidlertid, da den først debuterede, det var en a
Video:Gallium og historien om det periodiske systemKredit:The American Chemical Society Nogle kemikere ser måske det periodiske system med elementer som et helligt vidnesbyrd om videnskabens magt. Imidlertid, da den først debuterede, det var en a -
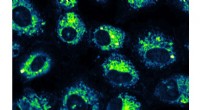 Spore, mål, trigger:Forskere udforsker kontrolleret CO-udslipEt mikroskopisk billede af menneskelige lungekræftceller, hvor det Utah State University-udviklede molekyle, der bærer kulilte, er vist at målrette mitokondrier, som afsløret af den klare gul-grønne f
Spore, mål, trigger:Forskere udforsker kontrolleret CO-udslipEt mikroskopisk billede af menneskelige lungekræftceller, hvor det Utah State University-udviklede molekyle, der bærer kulilte, er vist at målrette mitokondrier, som afsløret af den klare gul-grønne f -
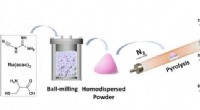 Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite
Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite -
 Nye måder at lave plantebaseret medicin på i rummet og på jordenKredit:CC0 Public Domain Hvordan kan man lave medicin i rummet? Det er et svært spørgsmål, da mange lægemidler, vi nyder på Jorden, bruger kemikalier, der kommer fra planter, og pladsen er næsten
Nye måder at lave plantebaseret medicin på i rummet og på jordenKredit:CC0 Public Domain Hvordan kan man lave medicin i rummet? Det er et svært spørgsmål, da mange lægemidler, vi nyder på Jorden, bruger kemikalier, der kommer fra planter, og pladsen er næsten
- Klimavenligt labribrug afhænger af en energirevolution, siger undersøgelse
- Hvilken farve i Star Schedlear CSSIOPIA?
- Hvordan klimaændringer vil påvirke malariatransmission
- Ressourceeffektivt blødt eksoskelet til mennesker med gangbesvær
- Hvad er udtrykket for sted, hvor en tidevand møder den nuværende flod?
- I blanding af sukker og vand, hvilken er hilsenen?


