Hvad reagerer en neutraliseringsreaktioner fra?
nøglekomponenter:
* syre: Et stof, der frigiver hydrogenioner (H+), når de opløses i vand. Eksempler inkluderer saltsyre (HCI), svovlsyre (H2SO4) og eddikesyre (CH3COOH).
* base: Et stof, der frigiver hydroxidioner (OH-), når de opløses i vand. Eksempler inkluderer natriumhydroxid (NaOH), kaliumhydroxid (KOH) og calciumhydroxid (Ca (OH) 2).
reaktionen:
Når en syre og en base reagerer, kombineres hydrogenionerne (H+) fra syren med hydroxidionerne (OH-) fra basen til dannelse af vand (H2O). Denne reaktion producerer også et salt, som er en ionisk forbindelse dannet af de resterende ioner.
Generel ligning:
Syre + base → salt + vand
Eksempel:
Hydrochlorsyre (HCI) + natriumhydroxid (NaOH) → natriumchlorid (NaCl) + vand (H2O)
Vigtige noter:
* neutralisering resulterer ikke altid i en perfekt neutral opløsning (pH 7). PH af den resulterende opløsning afhænger af styrkerne af den anvendte syre og den anvendte base.
* neutraliseringsreaktioner er eksoterm, hvilket betyder, at de frigiver varme.
* neutraliseringsreaktioner bruges i mange anvendelser, herunder:
* behandling af syreudslip: Baser kan bruges til at neutralisere syrer.
* fordøjelse: Mavesyre neutraliseres af basen i tyndtarmen.
* titrering: En teknik, der bruges til at bestemme koncentrationen af en opløsning.
Fortæl mig, hvis du gerne vil have flere oplysninger om neutraliseringsreaktioner, såsom specifikke eksempler eller hvordan pH ændrer sig under reaktionen!
Sidste artikelEr guld kemisk bundet eller en blanding?
Næste artikelHvilket målesystem bruges i øjeblikket i både kemi og handel?
 Varme artikler
Varme artikler
-
 Ny teknik til at forbedre duktiliteten af keramiske materialer til missiler, motorerPurdue University-forskere har udviklet en ny proces for at hjælpe med at overvinde keramiks skøre natur og gøre den mere holdbar. Kredit:Purdue University/Chris Adam Noget så simpelt som et elekt
Ny teknik til at forbedre duktiliteten af keramiske materialer til missiler, motorerPurdue University-forskere har udviklet en ny proces for at hjælpe med at overvinde keramiks skøre natur og gøre den mere holdbar. Kredit:Purdue University/Chris Adam Noget så simpelt som et elekt -
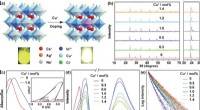 Cu+-doping øger selvfanget exciton-emission i legeret Cs2(Ag/Na)InCl6-dobbeltperovskita) Krystalstruktur af Cs2 (Ag/Na)InCl6 og det krystallografiske sted for Cu+ dopingmidler. PL-fotografierne (λex = 365 nm) for Cs2 (Ag/Na)InCl6 og Cs2 (Ag/Na)InCl6 :1,0 %Cu+ pulvere præsenteres, som v
Cu+-doping øger selvfanget exciton-emission i legeret Cs2(Ag/Na)InCl6-dobbeltperovskita) Krystalstruktur af Cs2 (Ag/Na)InCl6 og det krystallografiske sted for Cu+ dopingmidler. PL-fotografierne (λex = 365 nm) for Cs2 (Ag/Na)InCl6 og Cs2 (Ag/Na)InCl6 :1,0 %Cu+ pulvere præsenteres, som v -
 Forskere udvikler ny behandling for knogleinfektion ved hjælp af kobberrigt glasimplantatUndersøgelsens første forfatter Emily Ryan, en nyligt kvalificeret ph.d.-studerende i RCSI Institut for Anatomi, afbilledet med prof Fergal OBrien, Professor i bioingeniør og regenerativ medicin i RCS
Forskere udvikler ny behandling for knogleinfektion ved hjælp af kobberrigt glasimplantatUndersøgelsens første forfatter Emily Ryan, en nyligt kvalificeret ph.d.-studerende i RCSI Institut for Anatomi, afbilledet med prof Fergal OBrien, Professor i bioingeniør og regenerativ medicin i RCS -
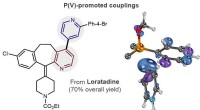 Bevæbning af narkojægere, kemikere designer ny reaktion til lægemiddelopdagelseDet venstre billede er en modifikation af antihistaminlægemidlet loratadin lavet via pyridin-pyridin-koblingsmetoden udviklet af CSU-kemikere. Den fede linje repræsenterer reaktionen, hvis resultat er
Bevæbning af narkojægere, kemikere designer ny reaktion til lægemiddelopdagelseDet venstre billede er en modifikation af antihistaminlægemidlet loratadin lavet via pyridin-pyridin-koblingsmetoden udviklet af CSU-kemikere. Den fede linje repræsenterer reaktionen, hvis resultat er
- Anvendelserne til vandmelon Rind
- Southern Illinois Len Lille dige vil sandsynligvis svigte, selvom den repareres, siger undersøgelse
- Hvordan kan jeg finde Mælkevejen i nattehimlen?
- Stjernebesat billede af Sextans B dværggalaksen viser astronomiske nysgerrigheder nær og fjern
- Hvad menes med atomicitet forklare med to eksempler?
- Fraktal undersøgelse beskriver COVID-19 transmissionsmønster


