Hvad er reglen for udskiftningsreaktioner?
Reglen for udskiftningsreaktioner:
Udskiftningsreaktioner, også kendt som enkeltfortrængningsreaktioner , følg en simpel regel:
Et mere reaktivt element vil fortrænge et mindre reaktivt element fra dets forbindelse.
Sådan fungerer det:
1. reaktanter: Du starter med et element (A) og en forbindelse (BC).
2. reaktivitet: Elementet (a) skal være mere reaktivt end elementet (b) i forbindelsen.
3. forskydning: Det mere reaktive element (a) erstatter det mindre reaktive element (b) i forbindelsen.
4. Produkter: Dette resulterer i et nyt element (B) og en ny forbindelse (AC).
Generel formel:
A + BC → AC + B
Nøglepunkter:
* reaktivitetsserie: Elementernes reaktivitet bestemmes af deres evne til at miste elektroner. En reaktivitetsserie viser elementer i rækkefølge af faldende reaktivitet.
* Forudsigelse af produkter: Du kan bruge reaktivitetsserien til at forudsige produkterne fra en erstatningsreaktion.
* Ikke alle reaktioner forekommer: Ikke alle elementer vil fortrænge andre fra deres forbindelser. For eksempel er kobber (Cu) mindre reaktiv end sølv (Ag), så kobber vil ikke fortrænge sølv fra dets sammensætning.
Eksempler:
* zinkreaktion med saltsyre: Zn + 2HCl → ZnCl2 + H2 (zink er mere reaktiv end brint og fortrænger det fra saltsyre)
* Iron, der reagerer med kobbersulfat: Fe + CUSO4 → FESO4 + CU (jern er mere reaktiv end kobber og fortrænger det fra kobbersulfat)
Husk: Denne regel gælder for både metaller og ikke -metaller . Imidlertid er reaktivitetsserien for metaller og ikke -metaller forskellig.
 Varme artikler
Varme artikler
-
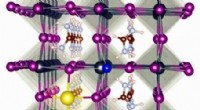 Et komplet sæt energiniveaupositioner for alle primære metalhalogenidperovskitterKredit:Eindhoven University of Technology Metalhalogenidperovskitter udgør en populær klasse af materialer med spændende optoelektroniske egenskaber. En grundlæggende forståelse af variationerne i
Et komplet sæt energiniveaupositioner for alle primære metalhalogenidperovskitterKredit:Eindhoven University of Technology Metalhalogenidperovskitter udgør en populær klasse af materialer med spændende optoelektroniske egenskaber. En grundlæggende forståelse af variationerne i -
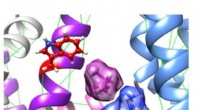 Forskere opdager molekylære mekanismer af gamle naturlægemidlerComputermodel af de to urtekomponenter, et isovalerinsyremolekyle (violet, øverst til venstre) og mallotoksin (blå, nederst til højre), optager tilstødende bindingssteder for synergistisk at aktivere
Forskere opdager molekylære mekanismer af gamle naturlægemidlerComputermodel af de to urtekomponenter, et isovalerinsyremolekyle (violet, øverst til venstre) og mallotoksin (blå, nederst til højre), optager tilstødende bindingssteder for synergistisk at aktivere -
 For kritisk syge patienter på livsstøtte, kemi kunne hjælpe dem med at overlevePolymerpiller med metal-organiske rammer indeni, som Melissa Reynolds laboratorium ved Colorado State University bruger til at lave biomedicinsk udstyr. Kredit:John Eisele/Colorado State University
For kritisk syge patienter på livsstøtte, kemi kunne hjælpe dem med at overlevePolymerpiller med metal-organiske rammer indeni, som Melissa Reynolds laboratorium ved Colorado State University bruger til at lave biomedicinsk udstyr. Kredit:John Eisele/Colorado State University -
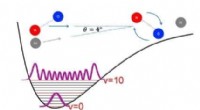 At skubbe studiet af ikke-kovalente intermolekylære interaktioner ind i et nyt områdeFigur af en kollision mellem et stærkt vibrerende NO-molekyle og et argonatom ved en lav kollisionsvinkel, får NO-molekylet til at rotere. Kredit:Hollandsk Organisation for Videnskabelig Forskning (NW
At skubbe studiet af ikke-kovalente intermolekylære interaktioner ind i et nyt områdeFigur af en kollision mellem et stærkt vibrerende NO-molekyle og et argonatom ved en lav kollisionsvinkel, får NO-molekylet til at rotere. Kredit:Hollandsk Organisation for Videnskabelig Forskning (NW
- En skyfri fremtid? Mysteriet i hjertet af klimaprognoser
- Europæisk alliance vil investere op til 6 mia. euro i batterier til elbiler
- Retten fastslår, at Trump EPA ulovligt ignorerede farlige kemikalier
- Presset for at gøre forsyningskæderne mere bæredygtige tager fortsat fart
- Hvordan drejer dansere hurtigt?
- Banebrydende eksperiment vil teste kvanteteoriens grænser


