Hvilken slags bindinger har molekyle butan?
* kovalente obligationer: Dette er de primære bindinger, der holder molekylet sammen. Hvert carbonatom danner fire kovalente bindinger, mens hvert hydrogenatom danner en. Carbonatomerne er knyttet til hinanden i en kæde, og hvert carbonatom er også bundet til hydrogenatomer.
* van der Waals Forces: Dette er svage intermolekylære kræfter, der findes mellem butanmolekyler. De stammer fra midlertidige udsving i elektronfordeling og skaber midlertidige dipoler. Disse kræfter bidrager til butanens fysiske egenskaber, såsom dets smeltepunkt og kogepunkt.
Her er en sammenbrud:
* carbon-carbon (C-C) obligationer: Dette er enkelt kovalente obligationer.
* carbon-hydrogen (C-H) obligationer: Disse er også enkelt kovalente obligationer.
Fortæl mig, hvis du gerne vil vide mere om kovalente obligationer eller van der Waals -styrker!
Sidste artikelHvor mange ting producerer metan?
Næste artikelNukleon er det elektrisk neutralt, den kaldte?
 Varme artikler
Varme artikler
-
 Ved hjælp af lys, røde blodlegemer og et honningbipeptid til at levere terapeutiske proteinerEt orange-rødt farvestof viser, at der dannes blodpropper i et musøre, hvor thrombin blev frigivet fra lysudløste RBCer. Skala bar, 50 μm. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/
Ved hjælp af lys, røde blodlegemer og et honningbipeptid til at levere terapeutiske proteinerEt orange-rødt farvestof viser, at der dannes blodpropper i et musøre, hvor thrombin blev frigivet fra lysudløste RBCer. Skala bar, 50 μm. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/ -
 Nyt bærbart malariascreeningsinstrument udvikletLaserstrålen passerer gennem blodprøven og rammer detektoren på den anden side. To målinger foretages:en med magneten ved siden af prøven og en uden magneten. Hvis der er hæmozoin i blodet, det vil
Nyt bærbart malariascreeningsinstrument udvikletLaserstrålen passerer gennem blodprøven og rammer detektoren på den anden side. To målinger foretages:en med magneten ved siden af prøven og en uden magneten. Hvis der er hæmozoin i blodet, det vil -
 Kemikere skaber en sensor, der nøjagtigt registrerer spyt-pH hos menneskerEn prøve af en kemosensor. Kredit:UrFU / Regina Pidgaetskaya Kemikere ved Ural Federal University har skabt en sensor til bestemmelse af pH i menneskeligt spyt. Dette er en fluorofor med stærk og s
Kemikere skaber en sensor, der nøjagtigt registrerer spyt-pH hos menneskerEn prøve af en kemosensor. Kredit:UrFU / Regina Pidgaetskaya Kemikere ved Ural Federal University har skabt en sensor til bestemmelse af pH i menneskeligt spyt. Dette er en fluorofor med stærk og s -
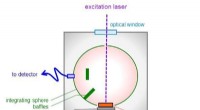 Forskere forbedrer metoden til at sondere halvledende krystaller med lys for at opdage defekter og u…Prøven placeres uden for den integrerende kugle og på en aluminiumsplade forbundet til en køleanordning. Kredit:Tohoku University Forskere fra Tohoku University har forbedret en metode til at sond
Forskere forbedrer metoden til at sondere halvledende krystaller med lys for at opdage defekter og u…Prøven placeres uden for den integrerende kugle og på en aluminiumsplade forbundet til en køleanordning. Kredit:Tohoku University Forskere fra Tohoku University har forbedret en metode til at sond
- Hvilken adskillelsesteknik er egnet til ammoniumchlorid og natriumchlorid?
- Kan store katte eksistere side om side? Undersøgelse udfordrer løvetrussel mod gepardunger
- Snapchat -forælder presset af fald i brugere
- De første organismer, der udviklede sig på Jorden for omkring 4 milliarder år siden, indikerer fo…
- Digitale teknologiers rolle i mobiliseringen af alt-right
- Hvad er en ionisk binding?


