Når du har 46 gram natrium reagerer med 160 ilt, hvor mange mol -oxid opnås?
1. Skriv den afbalancerede kemiske ligning:
4 na + o₂ → 2 na₂o
2. Beregn molen for hver reaktant:
* natrium (NA):
* Molmasse Na =22,99 g/mol
* Mol Na =(46 g) / (22,99 g / mol) =2 mol
* ilt (O₂):
* Molmasse O₂ =32 g/mol
* Mol O₂ =(160 g) / (32 g / mol) =5 mol
3. Bestem den begrænsende reaktant:
* Den afbalancerede ligning viser et forhold på 4:1 mol mellem natrium og ilt.
* Vi har 2 mol Na og 5 mol O₂. Dette betyder, at vi har mere end nok ilt til at reagere med alt natrium.
* Derfor er natrium den begrænsende reaktant .
4. Beregn molen af natriumoxid (NA₂O) produceret:
* Den afbalancerede ligning viser et 4:2 (eller 2:1) molforhold mellem natrium og natriumoxid.
* Da vi har 2 mol natrium, producerer vi:(2 mol na) * (1 mol na₂o / 2 mol na) = 1 mol na₂o
Svar: 1 mol natriumoxid (Na₂O) opnås.
Sidste artikelHvad får pH i en løsning til at hæve?
Næste artikelHvad er de kemikalier, der udgør savsmuld?
 Varme artikler
Varme artikler
-
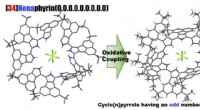 Syntese af en nær-infrarød lysabsorberende makrocyklisk aromatisk forbindelseSelektiv syntese af Cyclo [9] pyrroler Baseret på en oxidativ kobling. Kredit:Tetsuo Okujima, Ehime Universitet Profs. Okujima og Uno ved Ehime University, i samarbejde med prof. Kobayashi ved Shi
Syntese af en nær-infrarød lysabsorberende makrocyklisk aromatisk forbindelseSelektiv syntese af Cyclo [9] pyrroler Baseret på en oxidativ kobling. Kredit:Tetsuo Okujima, Ehime Universitet Profs. Okujima og Uno ved Ehime University, i samarbejde med prof. Kobayashi ved Shi -
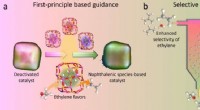 Forskere regenererer deaktiveret katalysator i methanol-til-olefin-processena. Første-principbaserede simuleringer giver kriterierne for stabilitet og funktionalitet af organiske mellemprodukter indespærret i nano-hulrum. b Selektiv omdannelse af koks til en specifik naphthal
Forskere regenererer deaktiveret katalysator i methanol-til-olefin-processena. Første-principbaserede simuleringer giver kriterierne for stabilitet og funktionalitet af organiske mellemprodukter indespærret i nano-hulrum. b Selektiv omdannelse af koks til en specifik naphthal -
 Energiforskere opfinder fejlfrie katalysatorerForskere ved Catalysis Center for Energy Innovation opfandt katalysatorteknologi, der kan accelerere kemiske reaktioner ved hjælp af bølger. Den banebrydende teknologi kan indarbejdes i hundredvis af
Energiforskere opfinder fejlfrie katalysatorerForskere ved Catalysis Center for Energy Innovation opfandt katalysatorteknologi, der kan accelerere kemiske reaktioner ved hjælp af bølger. Den banebrydende teknologi kan indarbejdes i hundredvis af -
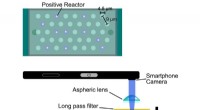 Smartphone virusscanner:Ny bærbar enhed lader smartphones tælle biologiske viraDe virusholdige hulrum er 4,5 mikrometer på tværs og 9 mikrometer fra hinanden. Kredit:Minagawa et al. Den nuværende førende metode til at vurdere tilstedeværelsen af vira og andre biologiske ma
Smartphone virusscanner:Ny bærbar enhed lader smartphones tælle biologiske viraDe virusholdige hulrum er 4,5 mikrometer på tværs og 9 mikrometer fra hinanden. Kredit:Minagawa et al. Den nuværende førende metode til at vurdere tilstedeværelsen af vira og andre biologiske ma


