Hvad får pH i en løsning til at hæve?
1. Tilføjelse af en base:
* Baser er stoffer, der donerer hydroxidioner (OH-), når de opløses i vand.
* Eksempler inkluderer:
* Stærke baser: Natriumhydroxid (NaOH), kaliumhydroxid (KOH)
* svage baser: Ammoniak (NH3), bagepulver (natriumbicarbonat, NAHCO3)
* Når du tilføjer en base til en opløsning, øger den direkte koncentrationen af OH-, hvilket fører til en højere pH.
2. Fjernelse af brintioner:
* Fjernelse af H+ -ioner fra en opløsning vil også skifte balance mod en højere pH. Dette kan ske igennem:
* reaktion med en base: Syrer reagerer med baser for at neutralisere hinanden, forbruge H+ og generere vand.
* reaktion med et metal: Nogle metaller reagerer med syrer for at danne salte og frigive brintgas (H2).
3. Temperaturændringer:
* Temperatur påvirker ioniseringen af vand: Ved højere temperaturer er det mere sandsynligt, at vandmolekyler ioniserer, hvilket producerer mere H+ og OH-. Imidlertid er stigningen i OH- generelt større, hvilket fører til en svag stigning i pH.
4. Opløsning af visse salte:
* Nogle salte, når de opløses i vand, kan hydrolysere, hvilket betyder, at de reagerer med vand for at producere enten H+ eller OH-.
* salte af svage syrer og stærke baser: Disse salte har en tendens til at hydrolysere for at producere OH- og hæver pH. Eksempel:Natriumacetat (CH3COONA).
* salte af stærke syrer og svage baser: Disse salte har en tendens til at hydrolysere for at producere H+, hvilket sænker pH. Eksempel:ammoniumchlorid (NH4CL).
Vigtig note:
* PH er en logaritmisk skala. En ændring af en pH-enhed repræsenterer en ti gange ændring i koncentrationen af H+ eller OH-.
* PH i en opløsning er et mål for dens surhed eller alkalinitet. En pH -værdi under 7 er sur, en pH på 7 er neutral, og en pH over 7 er alkalisk (grundlæggende).
 Varme artikler
Varme artikler
-
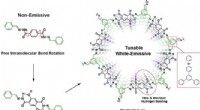 Justerbar emissiv organisk platformFigur viser designprincipperne for udvikling af en justerbar 2D COF, der er i stand til at udsende hvidt lys. Den frie intramolekylære bindingsrotation gør den grundlæggende molekylære enhed ikke-emit
Justerbar emissiv organisk platformFigur viser designprincipperne for udvikling af en justerbar 2D COF, der er i stand til at udsende hvidt lys. Den frie intramolekylære bindingsrotation gør den grundlæggende molekylære enhed ikke-emit -
 Kaffeforfalskning afdækket ved hjælp af ny metodeKredit:Quadram Institute Forskere fra Quadram Institute har udviklet en ny teknik til at skelne mellem overlegen Arabica -kaffe og billigere, lavere kvalitet Robusta. Ved hjælp af den nye teknik,
Kaffeforfalskning afdækket ved hjælp af ny metodeKredit:Quadram Institute Forskere fra Quadram Institute har udviklet en ny teknik til at skelne mellem overlegen Arabica -kaffe og billigere, lavere kvalitet Robusta. Ved hjælp af den nye teknik, -
 Video:Hvorfor limejuice brænder din hud i solenKredit:The American Chemical Society Vidste du, at det at lave margaritas og derefter tage til stranden kan give dig en smertefuld, hævelse brænde? I denne episode af Reaktioner, vi chatter med k
Video:Hvorfor limejuice brænder din hud i solenKredit:The American Chemical Society Vidste du, at det at lave margaritas og derefter tage til stranden kan give dig en smertefuld, hævelse brænde? I denne episode af Reaktioner, vi chatter med k -
 Selvhelende katalysatorfilm til brintproduktionForskning i retning af en mere effektiv brintproduktion:Stefan Barwe og hans kolleger. Kredit:RUB, Kramer Kemikere ved Center for Elektrokemiske Videnskaber ved Ruhr-Universität Bochum har udvikle
Selvhelende katalysatorfilm til brintproduktionForskning i retning af en mere effektiv brintproduktion:Stefan Barwe og hans kolleger. Kredit:RUB, Kramer Kemikere ved Center for Elektrokemiske Videnskaber ved Ruhr-Universität Bochum har udvikle
- Mikroenhed kunne opfange tidlige tegn på hjerteanfald eller slagtilfælde
- Hvilken slags fejl ville skabe en bjergkæde?
- røntgenstråler, computersimuleringer afslører krystalvækst
- Funktionelle grupper er en gruppe af molekyler knyttet til en kulstofbaseret kerne og et organisk mo…
- Betydelig ny opdagelse inden for teleportationsforskning:Støj kan forbedre kvaliteten af kvantete…
- Det er svært at måle AIs evne til at lære


