Hvor forekommer reaktioner i en elektrolytisk celle?
* anode: Dette er elektroden, hvor oxidation finder sted. Anoden er den positive elektrode i en elektrolytisk celle.
* katode: Dette er elektroden, hvor reduktion finder sted. Katoden er den negative elektrode i en elektrolytisk celle.
Her er en sammenbrud:
* Oxidation: Tabet af elektroner. Dette sker ved anoden.
* reduktion: Gevinsten af elektroner. Dette sker ved katoden.
Eksempel:
Ved elektrolyse af vand forekommer følgende reaktioner:
* anode (oxidation): 2H₂O → O₂ + 4H⁺ + 4E⁻
* katode (reduktion): 4H⁺ + 4E⁻ → 2H₂
I det væsentlige bruger den elektrolytiske celle elektrisk energi til at tvinge en ikke-spontan kemisk reaktion til at forekomme. Reaktionerne sker ved elektroderne, fordi elektroderne tilvejebringer overfladen til den elektronoverførsel, der er nødvendig for, at oxidation og reduktion finder sted.
Sidste artikelHvad er den forskellige i elektrolytisk og ikke-elektrolytisk opløsning?
Næste artikelHvad kalder du saltindholdet i vand?
 Varme artikler
Varme artikler
-
 Ny metode fremskynder udviklingen af medicinI laboratoriet hos Bernhard Spingler (r.), praktikant Philipp Nievergelt (l.) ydede et vigtigt bidrag til hurtigere og lettere at bestemme krystalstrukturerne af organiske salte. Kredit:UZH Forske
Ny metode fremskynder udviklingen af medicinI laboratoriet hos Bernhard Spingler (r.), praktikant Philipp Nievergelt (l.) ydede et vigtigt bidrag til hurtigere og lettere at bestemme krystalstrukturerne af organiske salte. Kredit:UZH Forske -
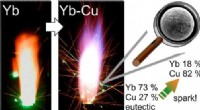 Forskere bruger sjældne jordarters metaller i legeringspulvere til at producere grønne, iøjnefald…Grafisk abstrakt. Kredit:ACS Omega (2022). DOI:10.1021/acsomega.2c03081 Stjernekastere kan være meget sjove - glimtende, brusende og spyttede lysbuer ud fra håndholdte pinde eller rør på jorden. Me
Forskere bruger sjældne jordarters metaller i legeringspulvere til at producere grønne, iøjnefald…Grafisk abstrakt. Kredit:ACS Omega (2022). DOI:10.1021/acsomega.2c03081 Stjernekastere kan være meget sjove - glimtende, brusende og spyttede lysbuer ud fra håndholdte pinde eller rør på jorden. Me -
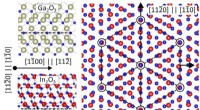 Ny katalytisk effekt fundet til fremstilling af galliumoxidMetaludvekslingskatalyse, som beskrevet, kan producere denne heterostruktur af galliumoxid-indiumoxid til ny elektronik baseret på galliumoxid. Kredit:PDI Halvledende oxider er en ny klasse af mat
Ny katalytisk effekt fundet til fremstilling af galliumoxidMetaludvekslingskatalyse, som beskrevet, kan producere denne heterostruktur af galliumoxid-indiumoxid til ny elektronik baseret på galliumoxid. Kredit:PDI Halvledende oxider er en ny klasse af mat -
 Bedragerisk enkel proces kan øge genanvendelsen af plastEva Harth, direktør for Welch-UH Center for Excellence in Polymer Chemistry ved University of Houston, sagde, at den nye metode adresserer et mangeårigt behov for industrielle plastproducenter, uden a
Bedragerisk enkel proces kan øge genanvendelsen af plastEva Harth, direktør for Welch-UH Center for Excellence in Polymer Chemistry ved University of Houston, sagde, at den nye metode adresserer et mangeårigt behov for industrielle plastproducenter, uden a
- Dødeligt folkeskare ved indisk religiøs forsamling viser, hvor farligt det kan være at forlade en…
- Hvorfor er lavvandede søer udsat for eutrofiering?
- Er en basketball homogen blanding eller heterogen blanding?
- Hvilket element, når det kombineres med fluor, ville sandsynligvis danne en ionisk?
- Hvad er den hotteste gule sol eller blå stjerne?
- Den eksperimentelle demonstration af en verificerbar blind kvanteberegningsprotokol


