Hvad er den forskellige i elektrolytisk og ikke-elektrolytisk opløsning?
Elektrolytiske opløsninger:
* Foretag elektricitet: Disse opløsninger indeholder ioner (ladede partikler), der er fri til at bevæge sig. Når der påføres en spænding, migrerer disse ioner mod den modsatte ladede elektrode og skaber en elektrisk strøm.
* indeholder elektrolytter: Elektrolytter er stoffer, der adskiller sig i ioner, når de opløses i et opløsningsmiddel, normalt vand. Almindelige eksempler inkluderer salte, syrer og baser.
* Eksempler: Saltvand, eddike, batterisyre og opløsninger af stærke syrer og baser.
Ikke-elektrolytiske opløsninger:
* Foretag ikke elektricitet: Disse løsninger indeholder ikke frie ioner. Molekylerne forbliver intakte og adskiller sig ikke til ladede arter.
* indeholder ikke-elektrolytter: Ikke-elektrolytter er stoffer, der ikke adskiller sig til ioner, når de opløstes i et opløsningsmiddel.
* Eksempler: Sukker opløst i vand, alkohol og rent vand.
Her er en tabel, der opsummerer de vigtigste forskelle:
| Funktion | Elektrolytisk opløsning | Ikke-elektrolytisk opløsning |
| --- | --- | --- |
| Konduktivitet | Udfører elektricitet | Foretager ikke elektricitet |
| Opløste stoffer | Elektrolytter (dissocieres i ioner) | Ikke-elektrolytter (dissocier ikke) |
| Eksempler | Saltvand, eddike, batterisyre | Sukkervand, alkohol, rent vand |
Hvorfor er ledningsevnen vigtig?
* Elektrokemi: Elektrolytiske opløsninger er vigtige for mange elektrokemiske processer, såsom elektroplettering, batterier og elektrolyse.
* biologi: Elektrolytter spiller en afgørende rolle i biologiske processer, herunder transmission af nerveimpuls, muskelsammentrækning og opretholdelse af væskebalance i kroppen.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse emner!
Sidste artikelHvilken gas frigøres efter den lette reaktionsfotosyntese?
Næste artikelHvor forekommer reaktioner i en elektrolytisk celle?
 Varme artikler
Varme artikler
-
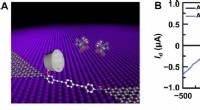 En enkelt-molekyle elektrisk tilgang til aminosyredetektion og chiralitetsgenkendelseEnhedsstruktur og elektrisk karakterisering. (A) Skematisk repræsentation af en PM-β-CD-baseret GMG-SMJ. Den molekylære maskine med en PM-β-CD var kovalent forbundet med grafenpunktkontakter gennem am
En enkelt-molekyle elektrisk tilgang til aminosyredetektion og chiralitetsgenkendelseEnhedsstruktur og elektrisk karakterisering. (A) Skematisk repræsentation af en PM-β-CD-baseret GMG-SMJ. Den molekylære maskine med en PM-β-CD var kovalent forbundet med grafenpunktkontakter gennem am -
 Quantum dot solcelleanlæg gør et varigt indtrykEn blysulfid-kvanteprik med langkædede overfladeligander. Solceller lavet med kvanteprikker viser stort løfte som næste generation af solcelleteknologi, men har brug for at demonstrere langsigtet stab
Quantum dot solcelleanlæg gør et varigt indtrykEn blysulfid-kvanteprik med langkædede overfladeligander. Solceller lavet med kvanteprikker viser stort løfte som næste generation af solcelleteknologi, men har brug for at demonstrere langsigtet stab -
 Cellekemi oplyst af laserlysRaman mikrospektroskopi hjælper forskere med at observere cellekemi ved at fokusere en laserstråle på et sted i en celle og derefter fange lys udsendt efter interaktioner med cellulære molekyler, som
Cellekemi oplyst af laserlysRaman mikrospektroskopi hjælper forskere med at observere cellekemi ved at fokusere en laserstråle på et sted i en celle og derefter fange lys udsendt efter interaktioner med cellulære molekyler, som -
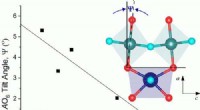 Opbygning af viden om ændringer i urankemiKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Der er stadig rigtig mange spørgsmål, der skal besvares inden for urankemi, især i forbindelse med det nukleare brændselskreds
Opbygning af viden om ændringer i urankemiKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Der er stadig rigtig mange spørgsmål, der skal besvares inden for urankemi, især i forbindelse med det nukleare brændselskreds
- Hvilken geografisk funktion skaber en naturlig grænselinie mellem mere end otte stater?
- Hvad er grundlæggende teori inden for videnskab?
- Stop-og-frisk på vej til skole
- Er betydningen af svag syre det samme som fortyndet syre?
- Politiuddannelse reducerede klager og magtanvendelse mod civile
- Hvilken fase er månen under en måneformørkelse?


