En enkelt-molekyle elektrisk tilgang til aminosyredetektion og chiralitetsgenkendelse
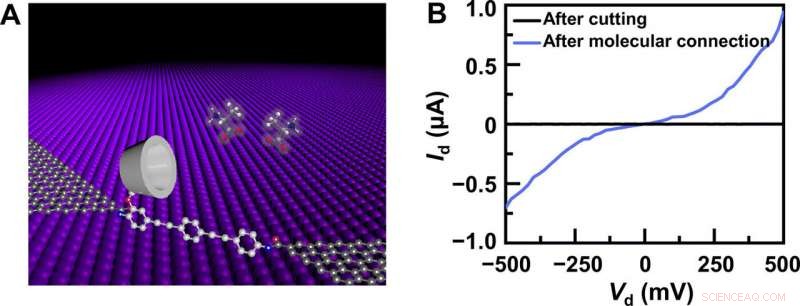
Enhedsstruktur og elektrisk karakterisering. (A) Skematisk repræsentation af en PM-β-CD-baseret GMG-SMJ. Den molekylære maskine med en PM-β-CD var kovalent forbundet med grafenpunktkontakter gennem amidbindinger. (B) I-V-kurver af GMG-SMJ'er efter oxygenplasmaskæring og efter yderligere molekylær forbindelse. Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.abe4365
Analytisk kemi sigter mod effektivt at skelne mellem to aminosyrer. I en ny rapport i Videnskabens fremskridt , Zihao Liu og et forskerhold i kemi, Fysik, og materialevidenskab i Kina og Japan, brugt en enkelt-molekyle elektrisk metode baseret på molekylære nanokredsløb til at danne stabile grafen-molekyle-grafen enkelt-molekyle junctions. Holdet udviklede disse molekylære forbindelser ved kovalent at binde en molekylær maskine. Derefter brugte de pH til at variere typen og ladningen af aminosyrerne for at finde forskellige multimodale strømudsving, der stammer fra forskellige værtsgæsteinteraktioner i forhold til teoretiske beregninger. Konduktansdataene producerede karakteristiske nivelleringstider og shuttlinghastigheder for hver aminosyre for at tillade nøjagtige og realtidsmålinger in situ. Forskerne testede fire aminosyrer og deres enantiomerer (chirale molekyler, der er spejlbilleder af hinanden) for at vise evnen til at skelne mellem dem på få mikrosekunder for at give en enkel og præcis metode til aminosyreidentifikation såvel som enkeltmolekyleprotein sekventering.
Byggesten af proteiner
Aminosyrer danner byggesten af proteiner, molekyler med særlige fysiologiske funktioner og centrale strukturelle elementer i lægemidler med anvendelser inden for biovidenskab. Forskere kan genkende enantiomerer af aminosyrer for at give vigtig information om kiral genkendelse og fysiologiske funktioner i biologiske systemer. Opdagelse af strukturen, enantiomer renhed og aminosyrers dynamiske adfærd kan fremme produktionen af nye teknikker til proteinsekventering og farmaceutiske undersøgelser. Påvisning og identifikation af aminosyrer med forskellige strukturer og chiralitet er kritisk vigtig på tværs af proteomik, lægemidler og nanobioteknologi. Imidlertid, eksisterende molekylære maskiner fungerer kun ved at sammenligne ensemblets termodynamiske parametre, hvilket er utilstrækkeligt. Det er derfor vigtigt at udvikle en generel molekylær teknik til at revolutionere de eksisterende metoder og genkende målmolekyler med høj nøjagtighed. I dette arbejde, Liu et al. demonstreret en enkelt-molekyle-teknik til direkte at identificere forskellige proteinogene aminosyrer og deres enantiomerer via nøjagtige dynamiske målinger af vært-gæst-interaktioner baseret på en enkelt-molekyle-teknik kendt som grafen-molekyle-grafen enkelt-molekyle junctions forkortet som GMG-SMJ'er til kovalent inkorporerer individuelle molekylære systemer, der opfører sig som den ledende kanal, i et elektrisk nanokredsløb.
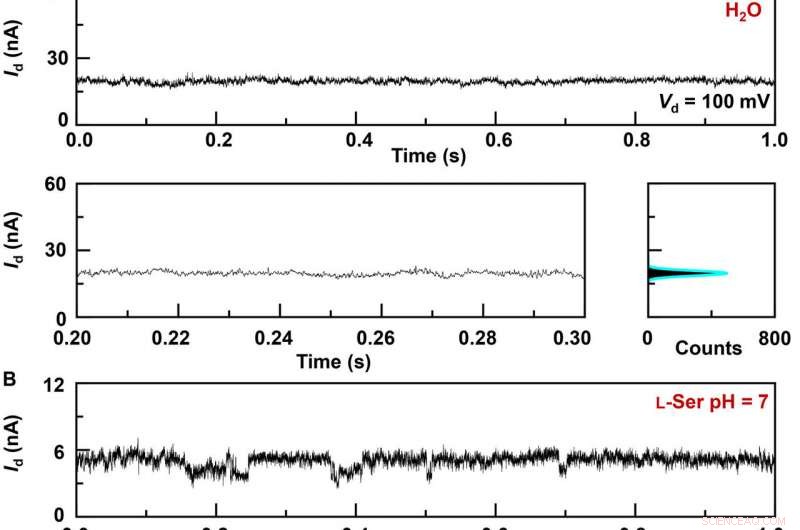
Aktuelle realtidsoptagelser af vært-gæst-interaktionsdynamik i GMG-SMJ'er. IT-kurver af forskellige GMG-SMJ'er (øverst), de forstørrede dele (nederst til venstre), og deres tilsvarende histogrammer (nederst til højre):(A) En fungerende enhed i et rent vand, (B) den samme enhed i en 100 nM L-Ser vandig opløsning, og (C) en anden indretning i en 100 nM L-Ala vandig opløsning. Indskud i histogrammerne er de forstørrede dele af de små toppe. pH =7, T =298 K, og forspændingen =0,1 V. Kredit:Science Advances, doi:10.1126/sciadv.abe4365
Den nye tilgang gav en robust platform til at danne enkelt-molekyle elektronik til at skabe molekylære optoelektroniske enheder. For at udvikle konstruktionerne, Liu et al. kovalent sandwichet en molekylær maskine mellem et par nano-gappede grafenpunktkontakter til aminosyredetektering og kiralitetsgenkendelse. Resultaterne vil åbne nye ruter til at udvikle nanoteknologien til nøjagtig enkeltmolekyle-proteinsekventering til praktiske anvendelser.
Udvikling af enheder, elektrisk karakterisering og realtidsmålinger
Forskerholdet syntetiserede enkeltlagsgrafen ved hjælp af kemisk dampaflejring på kobberfolier og overførte det til siliciumdioxid/siliciumwafers og mønstrede metalelektroderne ved hjælp af fotolitografi. For at udvikle de nano-gappede grafenpunktkontaktelektroder, de brugte en streg-line litografisk metode. De konstruerede derefter GMG-SMJ'er (grafen-molekyle-grafen enkeltmolekyle-forbindelser) ved kovalent at forbinde en enkelt molekylær maskine med grafenelektroder via amidbindinger. Holdet målte strøm-spændingskurverne for enhederne på en række forskellige stadier for at identificere dannelsen af GMG-SMJ'er. Ladningstransporten gennem krydset skyldtes enkeltmolekylære forbindelser. De udførte derefter tidsafhængige elektriske karakteriseringer for at overvåge konduktansen af permethylerede-β-cyclodextrin (PM-β-CD) enkeltmolekylære kryds (SMJ'er) i realtid. De målte først konstruktionerne i vand og derefter i forskellige opløsninger af forskellige aminosyrer. De repræsentative nuværende-tids-baner afslørede multiple-peak-fordelinger for forskellige aminosyrer i opløsning, såsom L-serin og L-alanin. De multiple distinkte tilstande af hver aminosyre stammer kun fra associationen/dissociationsprocessen mellem det funktionelle PM-β-CD-center og de omgivende aminosyrer.
Beregningsmæssige analyser af L-Ala@PM-β-CD SMJ'er. (A) Skematisk diagram af de beregnede grænsemolekylære orbitaler af den molekylære maskine. (B til D) Typiske molekylære konfigurationer under associationen med forskelligt ladede aminosyrer:(B) kation, (C) zwitterion, og (D) anion. (E) Tilsvarende transmissionsspektre ved en nul-forspænding. Det røde, gul, og grønne kurver viser transmissionen, når anionen, zwitterion, og kationformer var i hulrummet, henholdsvis. Den blå kurve viser hulrummet. De fulde spektre er tilvejebragt i fig. S4. (F til H) Skematisk fremstilling af aminosyrer i kation, zwitterion, og anionformer. Kredit:Science Advances, doi:10.1126/sciadv.abe4365 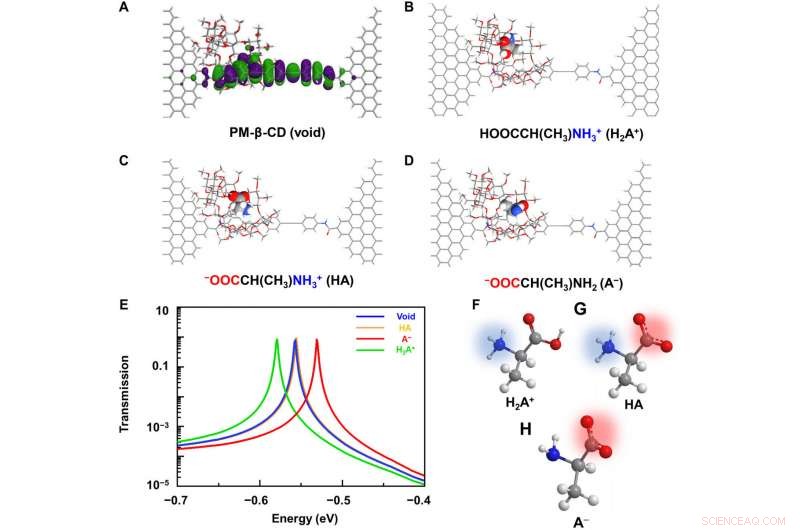
For bedre at forstå sammenhængen mellem vært-gæst-interaktioner i de L-alanin-baserede PM-β-CD enkeltmolekyleforbindelser, Liu et al. calculated the transmission spectra of the PM-β-CD host with differently charged L-Alanine guests. For at opnå dette, they used a nonequilibrium Green's function technique based on density functional theory as implied in the Atomistix Toolkit package. They noted the conductance contribution from the perturbed highest occupied molecular orbital (p-HOMO) to be dominant at low bias voltages as reflected with transmission spectra. The transmission spectra of the configurations were significantly different near the Fermi level of electrodes to afford different conductance stages. The researchers then analyzed the transitions between each level during amino acid recognition. They used L-alanine as an example to observe reversible transitions from the dissociation to form cations, zwitterions, and anion forms. The dissociation level dominated the device conductance, and the team collected the information using a four-state model, which described the transitions to understand the capacity to detect different structures of amino acids when interacting with PM-β-CD. The amino acids had at least two association processes for the carboxylic group and the other amino group. The greater the number of states recorded, the more accurate the recognition of results were.
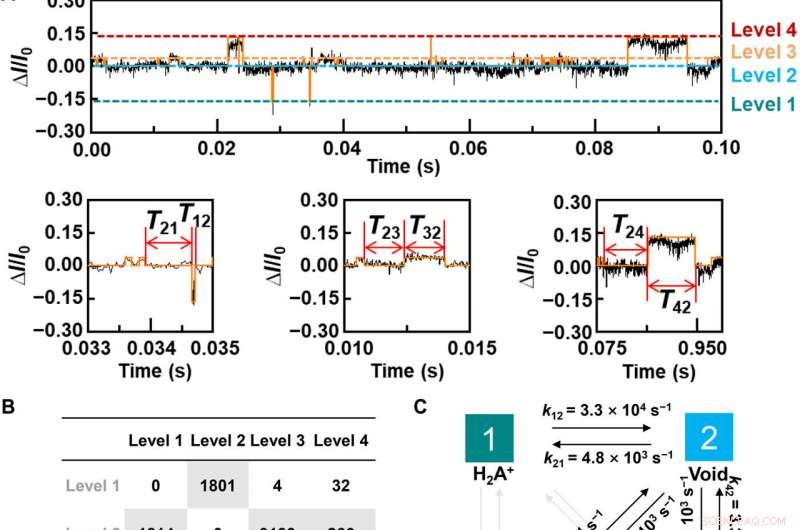
Dynamic analysis for L-Alanine detection. (A) Plot of ΔI/I0 as a function of time during the host-guest interaction. The red curve is the idealized fit by using a QuB software. pH =7, T =298 K, and the bias voltage =0.1 V. (B) Transition statistics between each state. The horizontal columns mean the initial state. (C) Kinetic model for the L-Ala recognition process. (D to I), Plots of time intervals of (D) level 1 to level 2, (E) level 2 to level 1, (F) level 2 to level 3, (G) level 3 to level 2, (H) level 2 to level 4, and (I) level 4 to level 2 at 298 K. Credit:Science Advances, doi:10.1126/sciadv.abe4365
Enantiomer recognition and outlook
Due to the similarity between enantiomers, it was more challenging to differentiate the structures compared to species identification. The associated energy differences were small and close to computational errors. To overcome these complexities, the team established a distinct "fingerprint database" for each amino acid to compare the conductance and kinetic data of different enantiomers. The team then achieved the current change and relaxation time data and compared them with the fingerprint database. Due to this universality, the method can also recognize chiral functional drug molecules to establish a broad approach for biomolecular detection at the single molecule-level.
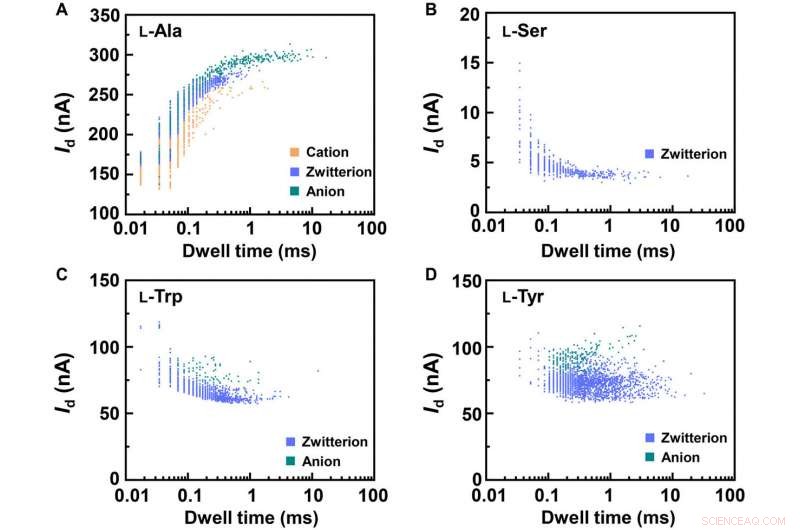
Statistical analyses of the translocation events for different amino acids. Translocation events (current as a function of the dwell time) were analyzed for (A) L-Ala, (B) L-Ser, (C) L-Trp, and (D) L-Tyr, henholdsvis. The two-dimensional (2D) contour plots are composed of all the events in 10-s recording at pH =7, showing the capability of detecting the different structures of amino acids when interacting with PM-β-CD. Kredit:Science Advances, doi:10.1126/sciadv.abe4365
På denne måde Zihao Liu and colleagues presented a practical single-molecule approach for real-time electrical recognition of amino acids with different structures and chirality within microseconds. The host-guest dynamic processes could be observed for diverse amino acids at the level of the anion, zwitterion and cation shuttling. Using the permethylated-β-cyclodextrin (PM-β-CD) complex, the team recognized differently charged states of amino acids based on current fluctuation range and thermodynamic/kinetic parameters. The technique can revolutionize existing methods to accurately sequence single-molecule gene/protein sequencing toward universal applications. The method can also offer a universal tool to recognize many important molecules in environmental or biological systems to understand the basis of life at the molecular level.
© 2021 Science X Network
 Varme artikler
Varme artikler
-
 Bærbar enhed til at snuse ud fangede menneskerKredit:American Chemical Society Det første trin efter bygninger kollapsede fra et jordskælv, bombning eller anden katastrofe er at redde mennesker, der kunne blive fanget i murbrokkerne. Men at f
Bærbar enhed til at snuse ud fangede menneskerKredit:American Chemical Society Det første trin efter bygninger kollapsede fra et jordskælv, bombning eller anden katastrofe er at redde mennesker, der kunne blive fanget i murbrokkerne. Men at f -
 Fremskridt hen imod tilslutning af en antibiotikapumpeSusan Rempe står foran Center for Integrated Nanotechnologies, hvor noget af hendes forskning om bakteriepumper blev lavet. Hendes team fra Sandia National Laboratories og University of Illinois i Urb
Fremskridt hen imod tilslutning af en antibiotikapumpeSusan Rempe står foran Center for Integrated Nanotechnologies, hvor noget af hendes forskning om bakteriepumper blev lavet. Hendes team fra Sandia National Laboratories og University of Illinois i Urb -
 Atomisk tynde perovskites booster til fremtidig elektronikKredit:National Institute for Materials Science WPI-MANA har udviklet verdens højeste ydeevne dielektriske nanofilm ved hjælp af atomisk tynde perovskiter. Denne teknologi kan revolutionere næst
Atomisk tynde perovskites booster til fremtidig elektronikKredit:National Institute for Materials Science WPI-MANA har udviklet verdens højeste ydeevne dielektriske nanofilm ved hjælp af atomisk tynde perovskiter. Denne teknologi kan revolutionere næst -
 Lysere fremtiden for halvlederbaserede fotokatalytiske processerAtom transfer radikal addition (ATRA) reaktion mellem diethylbrommalonat (DEBM) og 5-hexen-1-ol som en reaktionsmodel. Kredit:Dr. Paola Riente Et samarbejde mellem Pericàs-gruppen med Prof. Timoth
Lysere fremtiden for halvlederbaserede fotokatalytiske processerAtom transfer radikal addition (ATRA) reaktion mellem diethylbrommalonat (DEBM) og 5-hexen-1-ol som en reaktionsmodel. Kredit:Dr. Paola Riente Et samarbejde mellem Pericàs-gruppen med Prof. Timoth
- Ny scanningsteknik giver forskere mulighed for at læse ord på mumieaffaldspapir
- Metal for gummiagtigt til at skære? Tegn på det med en Sharpie eller limpind, siger videnskaben
- Et skridt tættere på at løse metan-mysteriet på Mars
- Forbedring af jernbanesektorens konkurrenceevne
- New Horizons-teamet øver sig til nytårs flyby
- Hvilke almindelige materialer absorberer mest energi fra solen?


