Hvis du starter med 32 gram CH4 og reagerer det O2 til dannelse af 88 CO2 72 H2O. Hvor meget i blev fortæret?
1. Skriv den afbalancerede kemiske ligning:
Ch₄ + 2o₂ → CO₂ + 2H₂O
2. Beregn den molære masse af hver forbindelse:
* CH₄:(12,01 g/mol) + (4 * 1,01 g/mol) =16,05 g/mol
* O₂:(2 * 16,00 g/mol) =32,00 g/mol
* CO₂:(12,01 g/mol) + (2 * 16,00 g/mol) =44,01 g/mol
* H₂O:(2 * 1,01 g/mol) + (16,00 g/mol) =18,02 g/mol
3. Bestem molen af ch₄:
* Mol ch₄ =(32 g) / (16,05 g / mol) =2 mol
4. Brug molforholdet fra den afbalancerede ligning for at finde molen af O₂ forbruges:
* Fra den afbalancerede ligning reagerer 1 mol CH₄ med 2 mol O₂.
* Mol O₂ =2 mol ch₄ * (2 mol o₂ / 1 mol ch₄) =4 mol o₂
5. Beregn massen af O₂ forbruges:
* Masse O₂ =(4 mol) * (32,00 g/mol) =128 g
Derfor blev 128 gram O₂ konsumeret i reaktionen.
Sidste artikelHvad er ikke og vigtige egenskaber ved et metal?
Næste artikelHvor mange atomer er der i ilt, og hvad de?
 Varme artikler
Varme artikler
-
 Elektronisk fast stof kan reducere kulstofemissioner i køleskabe og klimaanlægKredit:CC0 Public Domain En lovende erstatning for de giftige og brandfarlige drivhusgasser, der bruges i de fleste køleskabe og klimaanlæg, er blevet identificeret af forskere fra University of C
Elektronisk fast stof kan reducere kulstofemissioner i køleskabe og klimaanlægKredit:CC0 Public Domain En lovende erstatning for de giftige og brandfarlige drivhusgasser, der bruges i de fleste køleskabe og klimaanlæg, er blevet identificeret af forskere fra University of C -
 Vedvarende fotokonduktivitet bruges til at stimulere neurotypiske cellerEksponering af GaN for UV-lys forårsager en ophobning af elektroner ved den biologiske grænseflade, selv efter at lyset er fjernet. Dette fænomen, kendt som persistent fotokonduktivitet (PPC), kan bru
Vedvarende fotokonduktivitet bruges til at stimulere neurotypiske cellerEksponering af GaN for UV-lys forårsager en ophobning af elektroner ved den biologiske grænseflade, selv efter at lyset er fjernet. Dette fænomen, kendt som persistent fotokonduktivitet (PPC), kan bru -
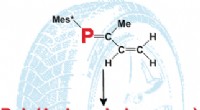 En kemisk funktionel fosforversion af naturgummiGoodyears opdagelse i 1839 af vulkaniseringen af naturgummi opnået fra gummitræer markerer begyndelsen på den moderne gummiindustri. En række syntetiske gummiprodukter blev efterfølgende udviklet. I
En kemisk funktionel fosforversion af naturgummiGoodyears opdagelse i 1839 af vulkaniseringen af naturgummi opnået fra gummitræer markerer begyndelsen på den moderne gummiindustri. En række syntetiske gummiprodukter blev efterfølgende udviklet. I -
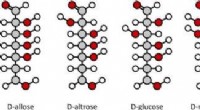 At knække sukkerkoden - hvorfor glykomet er den næste store ting inden for sundhed og medicinKredit:molekuul_be/shutterstock.com Når du tænker på sukker, du tænker sikkert på det søde, hvid, krystallinsk bordsukker, som du bruger til at lave småkager eller søde din kaffe. Men vidste du, a
At knække sukkerkoden - hvorfor glykomet er den næste store ting inden for sundhed og medicinKredit:molekuul_be/shutterstock.com Når du tænker på sukker, du tænker sikkert på det søde, hvid, krystallinsk bordsukker, som du bruger til at lave småkager eller søde din kaffe. Men vidste du, a
- Usædvanligt materiale kan forbedre pålideligheden af elektronik og andre enheder
- Matematik handler om undren, kreativitet og sjov, så lad os lære det på den måde
- Hvad er jordens omkreds ved 80 graders breddegrad?
- Berømte sorte ingeniører gennem historien
- Hvordan fotoner ændrer kemien
- Islandsk vulkan aftager efter første udbrud i 900 år


