Hvad er oxidationstilstanden for ilt i peroxider og superoxider?
* peroxider: I peroxider har ilt en oxidationstilstand på -1 . Dette skyldes, at peroxidanionen (O 2 2- ) har en -2 ladning, og da der er to iltatomer, har hvert iltatom en -1 -ladning. Et almindeligt eksempel er hydrogenperoxid (H 2 O 2 ).
* superoxider: I superoxider har ilt en oxidationstilstand på -1/2 . Dette skyldes, at superoxidanionen (O 2 - ) har en -1 ladning, og da der er to iltatomer, har hvert iltatom en -1/2 ladning. Et almindeligt eksempel er kaliumsuperoxid (KO 2 ).
Nøglekoncept: Oxidationstilstanden for et element repræsenterer den hypotetiske ladning, den ville have, hvis alle dens bindinger var 100% ioniske. Dette koncept hjælper os med at forstå elektronfordelingen og reaktiviteten af forbindelser.
 Varme artikler
Varme artikler
-
 Hvor gammelt er det fingeraftryk?Kredit:CC0 Public Domain Retsmedicinske dramaer på tv gør det nemt at afgøre, hvornår fingeraftryk blev efterladt på gerningsstedet. I virkeligheden nedbrydes olierne i fingeraftryk over tid, og de
Hvor gammelt er det fingeraftryk?Kredit:CC0 Public Domain Retsmedicinske dramaer på tv gør det nemt at afgøre, hvornår fingeraftryk blev efterladt på gerningsstedet. I virkeligheden nedbrydes olierne i fingeraftryk over tid, og de -
 Forbedring af kvantecomputereKredit:CC0 Public Domain I årtier, eksperter har forudsagt, at kvantecomputere en dag vil udføre vanskelige opgaver, såsom simulering af komplekse kemiske systemer, det kan ikke lade sig gøre med
Forbedring af kvantecomputereKredit:CC0 Public Domain I årtier, eksperter har forudsagt, at kvantecomputere en dag vil udføre vanskelige opgaver, såsom simulering af komplekse kemiske systemer, det kan ikke lade sig gøre med -
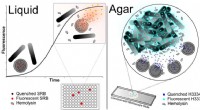 Lipidvesikler erstatter blod i ny bakterietestKredit:American Chemical Society Efterhånden som skoler rundt om i USA starter op igen, det samme gør ture til lægehuset. Men er den rå halsbetændelse på grund af bakterier, som kan bekæmpes med a
Lipidvesikler erstatter blod i ny bakterietestKredit:American Chemical Society Efterhånden som skoler rundt om i USA starter op igen, det samme gør ture til lægehuset. Men er den rå halsbetændelse på grund af bakterier, som kan bekæmpes med a -
 Blod fra stofbrugere kan afsløre stoffets oprindelseMirjam de Bruin-Hoegée udfører en kemisk analyse med LC-Orbitrap-MS. Kredit:University of Amsterdam Opioiden fentanyl bruges ikke kun i medicinsk praksis som smertestillende, men er også et populæ
Blod fra stofbrugere kan afsløre stoffets oprindelseMirjam de Bruin-Hoegée udfører en kemisk analyse med LC-Orbitrap-MS. Kredit:University of Amsterdam Opioiden fentanyl bruges ikke kun i medicinsk praksis som smertestillende, men er også et populæ
- Et plasmid Et fremmed gen og rekombinant DNA ville være forbundet med hvilken type organisme?
- For evigt mode:Rubik siger, at hans terning minder os om, hvorfor vi har hænder
- Størrelse betyder noget, når det kommer til atomare egenskaber
- Virkninger af et mudslide
- Hvordan ser frugtfluer i farve? Undersøgelse afslører menneskelignende hjernekredsløb på arbejde…
- Seneste fremskridt inden for tredimensionelle porøse kulstofmaterialer til elektromagnetisk bølgea…


