Hvad er mere reaktive alkalimetaller eller alkline jordmetaller?
* Elektronkonfiguration: Alkalimetaller har en valenselektron i deres yderste skal, hvilket gør dem ivrige efter at miste det elektron for at opnå en stabil ædelgaskonfiguration. Alkaliske jordmetaller har to valenselektroner.
* ioniseringsenergi: Alkalimetaller har lavere ioniseringsenergier end alkaliske jordmetaller. Dette betyder, at det kræver mindre energi at fjerne et elektron fra et alkalimetalatom, hvilket gør dem mere tilbøjelige til at deltage i reaktioner.
* Elektropositivitet: Alkalimetaller er mere elektropositive (hvilket betyder, at de har en tendens til at miste elektroner) end alkaliske jordmetaller.
Kortfattet: Alkali -metaller er mere reaktive, fordi de er lettere at ionisere og let miste deres enkelt valenselektron for at danne stabile kationer.
Eksempel:
Natrium (NA), et alkalimetal, reagerer kraftigt med vand og producerer brintgas og natriumhydroxid. Calcium (CA), et alkalisk jordmetal, reagerer med vand, men i en langsommere hastighed.
Sidste artikelHvorfor opbevares alkalimetaller i parafin?
Næste artikelEr alkalimetaller nogensinde fundet ukombineret i naturen?
 Varme artikler
Varme artikler
-
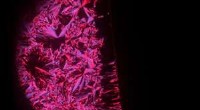 At bryde symmetri fører til responsive organiske fotodetektorerEt polariseret optisk mikroskopibillede af de søjleformede flydende krystaller klemt mellem to krydsede polarisatorer med (højre) og uden (venstre) et elektrisk felt. Dette tyder på, at anvendelse af
At bryde symmetri fører til responsive organiske fotodetektorerEt polariseret optisk mikroskopibillede af de søjleformede flydende krystaller klemt mellem to krydsede polarisatorer med (højre) og uden (venstre) et elektrisk felt. Dette tyder på, at anvendelse af -
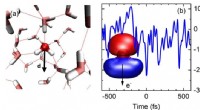 Stærke felter og ultrahurtige bevægelser - hvordan man genererer og styrer elektroner i flydende v…(a) Øjebliksbillede af arrangementet af vandmolekyler i væsken (rød:oxygenatomer, grå; hydrogenatomer). De stiplede linjer angiver hydrogenbindinger mellem molekylerne. Hvert vandmolekyle har et elekt
Stærke felter og ultrahurtige bevægelser - hvordan man genererer og styrer elektroner i flydende v…(a) Øjebliksbillede af arrangementet af vandmolekyler i væsken (rød:oxygenatomer, grå; hydrogenatomer). De stiplede linjer angiver hydrogenbindinger mellem molekylerne. Hvert vandmolekyle har et elekt -
 Ny metode til at fremme biofilmdannelse og øge effektiviteten af biokatalyseForskerne screenede syntetiske polymerer for deres evne til at inducere biofilmdannelse i en stamme af E. coli (MC4100), som er kendt for at være dårlig til at danne biofilm. De overvågede også biomas
Ny metode til at fremme biofilmdannelse og øge effektiviteten af biokatalyseForskerne screenede syntetiske polymerer for deres evne til at inducere biofilmdannelse i en stamme af E. coli (MC4100), som er kendt for at være dårlig til at danne biofilm. De overvågede også biomas -
 Kunstig intelligens kaster lys over membranydelsenKredit:King Abdullah University of Science and Technology Membranseparationer har længe været anerkendt som energieffektive processer med et hurtigt voksende marked. I særdeleshed, organisk opløsn
Kunstig intelligens kaster lys over membranydelsenKredit:King Abdullah University of Science and Technology Membranseparationer har længe været anerkendt som energieffektive processer med et hurtigt voksende marked. I særdeleshed, organisk opløsn
- Hvor langt er solsystemet fra solen i kilometer?
- Hvor mange trin er involveret i hans forenklede blyantspidser?
- Hvilket objekt i rummet har en meget stærk tyngdekraft?
- Hvad sker der med pH, når NaOH tilsættes buffer?
- Vegan er den nye vegetar - hvorfor supermarkeder skal gå 'plantebaserede' og hjælpe med at redde p…
- Var livet på den tidlige jord lilla?


