Hvorfor overvejer du ideel gas, mens du formulerer presset i lyset af kinetisk teori gas?
Imidlertid er denne formel kun strengt sandt for en ideel gas . Her er hvorfor:
Ideelle gasforudsætninger:
* Ingen intermolekylære kræfter: Ideelle gasmolekyler antages at have ingen attraktive eller frastødende kræfter mellem dem. Dette betyder, at de kun interagerer under kollisioner.
* ubetydelig molekylær volumen: Volumenet, der er optaget af selve gasmolekylerne, betragtes som ubetydelige sammenlignet med beholderens volumen.
Hvorfor ideel gas er afgørende:
* forenkling: Disse antagelser forenkler beregningerne i høj grad og gør teorien mere håndterbar. Rigtige gasser har intermolekylære kræfter og endelige molekylære volumener, hvilket gør beregninger meget mere komplekse.
* God tilnærmelse: Mens reelle gasser afviger fra ideel opførsel, især ved høje tryk og lave temperaturer, er den ideelle gasmodel en god tilnærmelse for mange situationer. Især ved lave tryk og høje temperaturer bliver afvigelserne mindre betydningsfulde.
Begrænsninger af ideel gasmodel:
* Ægte gasadfærd: Ægte gasser udviser afvigelser fra ideel opførsel på grund af intermolekylære kræfter og endelige molekylære volumener.
* van der Waals ligning: For at redegøre for reel gasadfærd blev der udviklet mere sofistikerede modeller som Van der Waals -ligningen.
Kortfattet:
Den ideelle gasmodel er vigtig i den kinetiske teori om gasser, fordi den forenkler beregningerne og giver en god tilnærmelse til mange situationer. Det er dog vigtigt at huske, at det har begrænsninger og ikke perfekt repræsenterer reel gasadfærd.
Sidste artikelKan du gøre smeltet metal solid igen?
Næste artikelHvad er den kemiske formel for bly II decasulfid?
 Varme artikler
Varme artikler
-
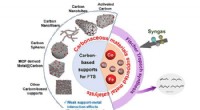 Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg
Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg -
 Diagnose af ikke-invasiv prostatakræft, overvågningPh.d. studerende Parissa Ziaei forbereder silica -nanospringe til et apparat til påvisning af prostatakræft i Su Has laboratorium på Gene and Linda Voiland School of Chemical Engineering and Bioengine
Diagnose af ikke-invasiv prostatakræft, overvågningPh.d. studerende Parissa Ziaei forbereder silica -nanospringe til et apparat til påvisning af prostatakræft i Su Has laboratorium på Gene and Linda Voiland School of Chemical Engineering and Bioengine -
 En fremtid med nyttige konstruerede levende maskiner?Ny blød, mekaniske metamaterialer kan tænke over, hvordan kræfter påføres det og reagere via forprogrammerede reaktioner. Kredit:Jennifer M. McCann / Elizabeth Flores-Gomez Murray, Penn State MR K
En fremtid med nyttige konstruerede levende maskiner?Ny blød, mekaniske metamaterialer kan tænke over, hvordan kræfter påføres det og reagere via forprogrammerede reaktioner. Kredit:Jennifer M. McCann / Elizabeth Flores-Gomez Murray, Penn State MR K -
 Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik
Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik
- Nye PFAS'er opdaget i Cape Fear River, selvom niveauet falder
- Hvor findes et flertal af aktive gletsjere i de nedre 48 stater?
- Sådan fungerer Liquid Body Armor
- Californiske agenturer er uenige om Colorado River tørkeplan
- Sporing af spildevandsvej til brønde, grundvand
- Tidskrystaller leder forskere til fremtidigt beregningsarbejde


