Hvor mange valenselektroner skal et element til at reagere med en 7 elektroner?
valenselektroner og reaktivitet
* Valenselektroner: Dette er elektronerne i den yderste skal af et atom. Det er dem, der er involveret i kemisk binding.
* stabilitet: Atomer stræber efter en stabil elektronkonfiguration, der ofte ligner de ædle gasser (gruppe 18) med en fuld ydre skal (normalt 8 elektroner).
* reaktivitet: Elementer med færre valenselektroner har en tendens til at være mere reaktive og søger at vinde eller dele elektroner for at opnå stabilitet. Elementer med næsten en fuld ydre skal er også reaktive og forsøger at miste elektroner.
elementet med 7 valenselektroner
Et element med 7 valenselektroner er en elektron væk fra en fuld ydre skal (som den ædle gas, i dette tilfælde, neon). Det vil være meget reaktivt, sandsynligvis * at få * en elektron for at afslutte sin ydre skal.
Det andet elements valenselektroner
For at bestemme, hvor mange valenselektroner det andet element skal have, skal du overveje disse muligheder:
* ionisk binding: Elementet med 7 elektroner ville sandsynligvis få et elektron og danne en negativ ion (anion). Det andet element skulle miste et elektron for at blive en positiv ion (kation) og danne en stabil ionisk binding. Dette betyder, at det andet element skal have 1 valenselektron (gruppe 1 -metaller som lithium eller natrium).
* kovalent binding: Elementet med 7 elektroner kunne dele et elektron med et andet element og danne en kovalent binding. Det andet element kunne bidrage med et elektron til det delte par. Dette betyder, at det andet element kunne have 1, 3, 5 eller 7 valenselektroner.
Eksempler:
* ionisk binding: Natrium (1 valenselektron) og chlor (7 valenselektroner) danner natriumchlorid (NaCI) gennem ionisk binding.
* kovalent binding: Klor (7 valenselektroner) og brint (1 valenselektron) danner hydrogenchlorid (HCI) gennem kovalent binding.
Kortfattet
Elementet med 7 valenselektroner reagerer mest let med elementer, der let kan miste en elektron (som dem i gruppe 1) gennem ionisk binding. Det kan også danne kovalente bindinger med elementer, der kan dele en elektron.
Sidste artikelHvad væsken, der blev brugt til udskrivning?
Næste artikelHvor mange valenselektroner har et neutralt strontiumatom?
 Varme artikler
Varme artikler
-
 Forskere smider nye beregningsværktøjer til at lave mere præcise forudsigelser af proteinstruktur…Forskere fra Rice University blev inspireret af smedens gamle arbejde, da de forfinede deres beregningsmodeller for, hvordan proteiner foldes. Modellerne er beregnet til at hjælpe strukturbiologer, de
Forskere smider nye beregningsværktøjer til at lave mere præcise forudsigelser af proteinstruktur…Forskere fra Rice University blev inspireret af smedens gamle arbejde, da de forfinede deres beregningsmodeller for, hvordan proteiner foldes. Modellerne er beregnet til at hjælpe strukturbiologer, de -
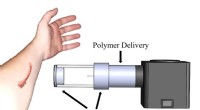 Sprøjt maling af fiberbind på sårIllustration af den elektrostatiske og luftdrevne enhed opsat til direkte afsætning af en bandage på et sårsted. Kredit:L.G. Huston og E.A. Kooistra-Manning, Montana teknologiske universitet Med n
Sprøjt maling af fiberbind på sårIllustration af den elektrostatiske og luftdrevne enhed opsat til direkte afsætning af en bandage på et sårsted. Kredit:L.G. Huston og E.A. Kooistra-Manning, Montana teknologiske universitet Med n -
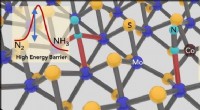 Ammoniaksyntese gjort let med 2-D katalysatorTilsætning af koboltatomer til fyldning af ledige pladser i 2D molybdendisulfidkrystaller øger materialets evne til at katalysere ammoniak fra dinitrogen. Forskere fra Rice University har udviklet en
Ammoniaksyntese gjort let med 2-D katalysatorTilsætning af koboltatomer til fyldning af ledige pladser i 2D molybdendisulfidkrystaller øger materialets evne til at katalysere ammoniak fra dinitrogen. Forskere fra Rice University har udviklet en -
 Forskere opdager en ny mekanisme til at øge styrken og duktiliteten af højentropi-legeringerStress-strain-kurve og dislokationskonfiguration/evolution i MPEAer. (A) er et diagram over DDD-simuleringer for MPEAer. Kredit:Li, Jia et al. Et forskerhold ledet af materialeforskere fra City Uni
Forskere opdager en ny mekanisme til at øge styrken og duktiliteten af højentropi-legeringerStress-strain-kurve og dislokationskonfiguration/evolution i MPEAer. (A) er et diagram over DDD-simuleringer for MPEAer. Kredit:Li, Jia et al. Et forskerhold ledet af materialeforskere fra City Uni
- Uligheder i Storbritannien kan påvises ved hjælp af deep learning billedanalyse
- Forstå tyngdekraften:Nanoskalasøgningen efter ekstra dimensioner
- Lav-temp fotokatalysator kunne skære ned på CO2-fodaftrykket for syngas
- Hvor mange meter på 51 fod?
- Hvad er en stor kold sky af gas og støv i det interstellære rum?
- Byer med flere sorte indbyggere er mere afhængige af trafikbilletter og bøder for indtægter


