Hvorfor er hastigheden for en kemisk reaktion sandsynligvis fremskyndt, hvis temperaturen stiger?
1. Øget kinetisk energi:
- Højere temperaturer betyder, at molekyler har mere kinetisk energi og bevæger sig hurtigere.
- Denne øgede bevægelse fører til hyppigere kollisioner mellem reaktantmolekyler.
- Flere kollisioner øger sandsynligheden for vellykkede kollisioner, hvor molekylerne har nok energi til at overvinde aktiveringsenergibarrieren og reagere.
2. Øget kollisionsfrekvens:
- hurtigere bevægende molekyler kolliderer oftere med hinanden.
- Denne øgede kollisionsfrekvens øger chancerne for effektive kollisioner, der fører til produktdannelse.
3. Øget brøkdel af molekyler med tilstrækkelig energi:
- Mens temperaturen øger den kinetiske energi i alle molekyler, vil nogle molekyler have signifikant højere energi end andre.
- Ved højere temperaturer har en større andel af molekyler nok energi til at overvinde aktiveringsenergibarriere og reagere.
4. Aktiveringsenergi og reaktionshastighed:
- Aktiveringsenergien er den minimale mængde energi, der kræves for reaktanter til at danne produkter.
- Forøgelse af temperaturen øger brøkdelen af molekyler, der har nok energi til at nå aktiveringsenergien, hvilket fører til en hurtigere reaktionshastighed.
Generelt fører den kombinerede virkning af øget kinetisk energi, kollisionsfrekvens og brøkdel af molekyler med tilstrækkelig energi til en hurtigere reaktionshastighed ved højere temperaturer.
Vigtig note:
- Ikke alle reaktioner fremskynder med temperaturen. Nogle reaktioner er eksoterme og kan bremse ved højere temperaturer på grund af ligevægtsskift.
- Den specifikke virkning af temperatur på reaktionshastigheden afhænger af reaktionens aktiveringsenergi og arten af reaktanterne.
 Varme artikler
Varme artikler
-
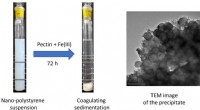 Interaktion mellem nanoplast og pektin, et vandopløseligt polysaccharidVenstre billede:Billedet af en nano-polystyrensuspension (500 mg L−1, pH 7) (venstre) og nanopolystyrensuspensionen efter tilsætning af pektin (15 mg L−1) og Fe(III) (0,10 mM) efter opbevaring i 72 ti
Interaktion mellem nanoplast og pektin, et vandopløseligt polysaccharidVenstre billede:Billedet af en nano-polystyrensuspension (500 mg L−1, pH 7) (venstre) og nanopolystyrensuspensionen efter tilsætning af pektin (15 mg L−1) og Fe(III) (0,10 mM) efter opbevaring i 72 ti -
 Borat bioaktivt glas i nanoskala:Et næste generations materiale til hudhelingBorat bioaktivt glas i nanoskala. Kredit:MA Kun For nylig, ved hjælp af en steady-state stærk magnetfelt eksperimentel enhed, forskere konstruerede bioaktivt boratglas i nanoskala (Nano-HCA@BG), s
Borat bioaktivt glas i nanoskala:Et næste generations materiale til hudhelingBorat bioaktivt glas i nanoskala. Kredit:MA Kun For nylig, ved hjælp af en steady-state stærk magnetfelt eksperimentel enhed, forskere konstruerede bioaktivt boratglas i nanoskala (Nano-HCA@BG), s -
 En metode til at genvinde skjulte serienumre fra polymerprodukterGendannelse af slettede serienumre i en polymer. Kredit:American Chemical Society Polymerer er meget udbredt i industrien og anvendes i stigende grad som erstatninger for metaller ved fremstilling
En metode til at genvinde skjulte serienumre fra polymerprodukterGendannelse af slettede serienumre i en polymer. Kredit:American Chemical Society Polymerer er meget udbredt i industrien og anvendes i stigende grad som erstatninger for metaller ved fremstilling -
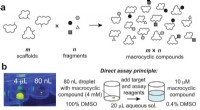 Store antal makrocykliske forbindelser, der er nødvendige for at udvikle lægemidler mod vanskelige…Diversificering af makrocykliske stilladser ved kombinatorisk at tilføje fragmenter til perifere grupper. et generelt princip for tilgangen. b Billede af en 80 nL dråbe overført af ADE, vist i en 96-b
Store antal makrocykliske forbindelser, der er nødvendige for at udvikle lægemidler mod vanskelige…Diversificering af makrocykliske stilladser ved kombinatorisk at tilføje fragmenter til perifere grupper. et generelt princip for tilgangen. b Billede af en 80 nL dråbe overført af ADE, vist i en 96-b
- Hvem var den første, der tænkte på geotermisk energi?
- Forskere forklæder stoffer som blodplader for at målrette kræft
- Genopbygning af jordmikrobiomer i højtunnel landbrugssystemer fokus for undersøgelse
- Hvordan adskiller kræftcellers opførsel sig fra de normale celler?
- Atapuerca-hominidernes tandemalje voksede hurtigere end hos moderne mennesker
- Typer af truede regnskovsplanter


