Store antal makrocykliske forbindelser, der er nødvendige for at udvikle lægemidler mod vanskelige sygdomsmål syntetiseret
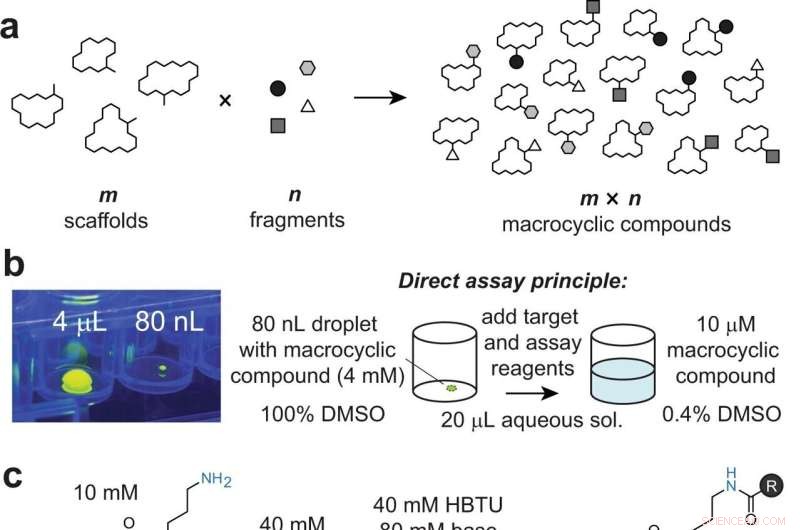
Diversificering af makrocykliske stilladser ved kombinatorisk at tilføje fragmenter til perifere grupper. et generelt princip for tilgangen. b Billede af en 80 nL dråbe overført af ADE, vist i en 96-brønds plade og ved siden af en 4 μL dråbe til skala. Dråberne indeholder fluorescein til visualisering med UV-lys. Tilsætning af mål- og assay-reagens til 80 nL makrocykliske reaktioner fortynder det organiske opløsningsmiddel til 0,4 %, hvilket er kompatibelt med bioassays. c Model makrocyklisk stillads 1 indeholdende en perifer primær amin (blå), der er modificeret ved acylering. d Reaktion af model makrocyklus 1 med angivne syrer 1–8, kvantificeret ved HPLC (absorbans og/eller iontal). Det første tal angiver konvertering ved 4 µL volumen via pipettering med DIPEA. Det andet og tredje tal angiver konvertering ved 80 nL via akustisk væskeoverførsel med henholdsvis DIPEA og DABCO. e Tilfældigt udvalgte ikke-peptid stilladser indeholdende mindre tilgængelige aminogrupper (i blåt). Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-31428-8
Forskere ved EPFL har fundet en måde at syntetisere et stort antal makrocykliske forbindelser, som er nødvendige for at udvikle lægemidler mod vanskelige sygdomsmål.
Når farmaceutiske virksomheder begynder at lede efter en lægemiddelkandidat, bruger de en filtreringsproces kendt som "high-throughput screening." Her testes et stort antal forskellige kemiske forbindelser for at se, hvilke der vil binde sig til et protein, der er målet for den sygdom, de ønsker at adressere.
Farmaceutiske virksomheder har faktisk biblioteker med 1-2 millioner "småmolekyler"-forbindelser indsamlet over år. Men i mange tilfælde kan screening af klassiske småmolekyleforbindelser ikke identificere lægemiddelkandidater, blot fordi de ikke indeholder en forbindelse, der binder tilstrækkeligt stærkt til målet.
En løsning er blevet fundet i "makrocyklerne", en ny klasse af molekyler, der har vist sig at være ideelle til at binde vanskelige mål som proteiner med flade overflader eller endda proteiner bundet til andre proteiner. Problemet er, at nuværende makrocyklusbiblioteker kun indeholder mindre end 10.000 forbindelser, hvilket begrænser chancen for at finde lægemiddelkandidater, der kan binde et givet sygdomsmål.
Men en gruppe kemikere ved EPFL har nu fundet en måde at generere et stort antal makrocykler, som kan øge størrelsen af tilgængelige biblioteker betydeligt. Gennembruddet, udgivet i Nature Communications , er arbejdet for gruppen af professor Christian Heinis ved EPFL's School of Basic Sciences.
"Vores tilgang er baseret på at kombinere et stort antal 'm' af forskellige makrocykliske stilladser med et utal af 'n' kemiske fragmenter for at generere 'm×n' forskellige makrocykliske forbindelser," siger Heinis. "For eksempel genererede vi et bibliotek med 19.968 makrocykler ved at reagere 192 makrocykliske stilladser med 104 carboxylsyrefragmenter."
Med hjælp fra EPFL's Biomolecular Screening Facility udførte forskerne reaktionerne i små mængder på 40 nanoliter og ved at overføre reagenserne ved hjælp af akustiske bølger, hvilket er enormt hurtigt. Gennem miniaturiseringen og den høje hastighed blev biblioteket med 19.968 makrocykliske forbindelser sat sammen på kun en halv dag.
For at teste metoden afprøver ph.d. studerende, der leder projektet, Sevan Habeshian, brugte det til at udvikle nanomolære inhibitorer mod thrombin og MDM2:p53 protein-protein-interaktionen, som er lægemiddelmål for slagtilfælde og kræft.
I samarbejde med forskere fra universiteterne i Padova og Venedig fik holdet en røntgenstruktur af thrombininhibitoren, mens den bandt proteinet. "Den strukturelle analyse validerede tilgangen til at screene forbindelser indeholdende makrocykliske kerner og lateralt forbundne kemiske fragmenter," siger Habeshian.
"Vi anvender i øjeblikket tilgangen til at udvikle makrocykliske forbindelser til en række sygdomsmål, som farmaceutiske virksomheder kæmper for at generere lægemidler baseret på klassiske små molekyler for," siger Heinis. "I betragtning af den lille størrelse og den begrænsede polære overflade af makrocykliske forbindelser har de en høj chance for at passere gennem cellemembraner, hvilket betyder, at de kan bruges til at udvikle lægemidler til intracellulære mål eller endda lægemidler, der tages oralt." + Udforsk yderligere
Nye ringslutningsreaktioner til syntetisering af makrocykliske lægemiddelledninger
 Varme artikler
Varme artikler
-
 Ny cellemembranmodel kan være nøglen til at afdække nye proteinegenskaberForskere brugte neutron- og røntgenspredningsteknikker ved Oak Ridge og Brookhaven National Laboratories til at karakterisere skiveformede strukturer, kendt som biceller, der efterligner cellemembrane
Ny cellemembranmodel kan være nøglen til at afdække nye proteinegenskaberForskere brugte neutron- og røntgenspredningsteknikker ved Oak Ridge og Brookhaven National Laboratories til at karakterisere skiveformede strukturer, kendt som biceller, der efterligner cellemembrane -
 Koordinationspolymerglas giver solid støtte til brintbrændselscellerMolekylstrukturen af det nye polymerglas letter bevægelsen af protoner (H+) hen over det under tørre forhold ved 120 ° C. Kredit:Mindy Takamiya/Kyoto University iCeMS Forskere ved Japans Insti
Koordinationspolymerglas giver solid støtte til brintbrændselscellerMolekylstrukturen af det nye polymerglas letter bevægelsen af protoner (H+) hen over det under tørre forhold ved 120 ° C. Kredit:Mindy Takamiya/Kyoto University iCeMS Forskere ved Japans Insti -
 Hvorfor fotosyntese virker bedre for nogle planter end andreFigur 1:Opladningsfordeling på aktive steder og CO2 -genkendelsesevne for forskellige typer RuBisCO. S rel i grafen viser værdien, der angiver CO2 -genkendelsesevnen for hver RuBisCO. Jo højere værdi,
Hvorfor fotosyntese virker bedre for nogle planter end andreFigur 1:Opladningsfordeling på aktive steder og CO2 -genkendelsesevne for forskellige typer RuBisCO. S rel i grafen viser værdien, der angiver CO2 -genkendelsesevnen for hver RuBisCO. Jo højere værdi, -
 Solmateriale kan selvhelbredende ufuldkommenheder, viser ny forskningKredit:CC0 Public Domain Et materiale, der kan bruges i teknologier som solenergi, har vist sig at selvhelbredende, viser en ny undersøgelse. Resultaterne - fra University of York - rejser udsigt
Solmateriale kan selvhelbredende ufuldkommenheder, viser ny forskningKredit:CC0 Public Domain Et materiale, der kan bruges i teknologier som solenergi, har vist sig at selvhelbredende, viser en ny undersøgelse. Resultaterne - fra University of York - rejser udsigt
- I damskum, videnskabsmænd finder svar på en udvikling, som kom først
- Forskel mellem spektrometer og spektrofotometer
- Kvinders stemmer i medierne er stadig færre end mænds:undersøgelse
- Forskere skaber alternativ plast ved hjælp af kun sukkerarter og CO2
- Det spanske leveringsfirma Glovo er ude for at erobre verden
- Hvorfor skaber britiske forskere en human-gris hybrid?


