Hvad er den termiske karakter af en reaktion?
eksotermiske reaktioner:
* Slip varme ind i omgivelserne.
* Produkterne har lavere energi end reaktanterne.
* Ændringen i entalpi (ΔH) er negativ .
* Eksempler:forbrænding af brændstof, forbrænding, neutralisering af syre og base.
endotermiske reaktioner:
* absorberer varme fra omgivelserne.
* Produkterne har højere energi end reaktanterne.
* Ændringen i entalpi (ΔH) er positiv .
* Eksempler:Meltis, fotosyntese, opløst ammoniumnitrat i vand.
Nøglekoncepter:
* entalpi (h) er en termodynamisk egenskab, der repræsenterer det samlede varmeindhold i et system.
* Ændring i entalpi (ΔH) er forskellen i entalpi mellem produkter og reaktanter.
* Termokemiske ligninger er afbalancerede kemiske ligninger, der inkluderer enthalpiændringen (ΔH).
hvordan man bestemmer termisk karakter:
1. observer temperaturændring: Hvis omgivelserne bliver varmere, er det eksoterme. Hvis omgivelserne bliver koldere, er det endotermisk.
2. entalpiændring (ΔH): En negativ ΔH indikerer en eksoterm reaktion, mens en positiv ΔH indikerer en endotermisk reaktion.
Kortfattet:
Den termiske karakter af en reaktion fortæller os om varmestrømmen under reaktionen. Det er et vigtigt aspekt ved at forstå kemiske processer og deres indflydelse på det omgivende miljø.
Sidste artikelI hvilken retning skal gasregulatoren vendes for at indrømme mere i tønde?
Næste artikelEr amminosyre en organisk syre?
 Varme artikler
Varme artikler
-
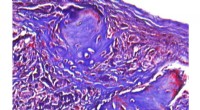 Nye hydrogeler viser lovende behandling af knogledefekterDer er vist et mikroskopisk billede af regenereret knogle i en kraniedefekt hos en mus. Kredit:University of California, Los Angeles Bioingeniører og tandlæger fra UCLA School of Dentistry har udv
Nye hydrogeler viser lovende behandling af knogledefekterDer er vist et mikroskopisk billede af regenereret knogle i en kraniedefekt hos en mus. Kredit:University of California, Los Angeles Bioingeniører og tandlæger fra UCLA School of Dentistry har udv -
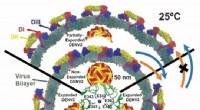 Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in
Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in -
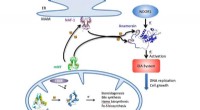 MiNT -protein et nyt mål for at angribe sygdomEn illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metabol
MiNT -protein et nyt mål for at angribe sygdomEn illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metabol -
 Fejl fundet i vandbehandlingsmetoden - Processen kan uforvarende generere skadelige kemikalierKredit:CC0 Public Domain Offentlig vandkvalitet har fået stor opmærksomhed i de senere år, da der er gjort nogle foruroligende opdagelser vedrørende blyniveauer i byer over hele landet. Nu, en ny
Fejl fundet i vandbehandlingsmetoden - Processen kan uforvarende generere skadelige kemikalierKredit:CC0 Public Domain Offentlig vandkvalitet har fået stor opmærksomhed i de senere år, da der er gjort nogle foruroligende opdagelser vedrørende blyniveauer i byer over hele landet. Nu, en ny
- Hvad er den værdi, der fortæller dig, om er fossil yngre eller ældre?
- Forskere udvikler hurtig og energibesparende syntesemetode til nye elektrokatalysatorer
- En tabel udøver en 4,0 kg Newton -styrke på bogen, der ligger ved hvile, den udøves af IS?
- Sådan beregnes sandsynlighed
- Sætning forklarer, hvorfor mængder som varme og effekt kan svinge i det mikroskopiske system
- Sådan fungerer fly


