Hvorfor er formlen med natrium og klor NaCl ikke NCCL2?
1. Valency:
* natrium (NA) Har en valens på +1, hvilket betyder, at den mister en elektron for at opnå en stabil elektronkonfiguration.
* klor (Cl) Har en valency på -1, hvilket betyder, at den får en elektron for at opnå en stabil elektronkonfiguration.
2. Ionisk binding:
Natriumchlorid danner en ionisk binding , hvor natrium donerer sin ene elektron til klor. Dette resulterer i dannelsen af et positivt ladet natriumion (Na+) og en negativt ladet chloridion (Cl-).
3. Elektrostatisk tiltrækning:
De modsatte ladede ioner tiltrækker hinanden på grund af elektrostatiske kræfter og danner en stærk ionisk binding. Forholdet mellem ioner i forbindelsen bestemmes af behovet for at afbalancere anklagerne.
4. Neutral forbindelse:
I NaCl balancerer en natriumion (Na +) med en +1 ladning ladningen af en chloridion (Cl-) med en -1 -ladning. Dette resulterer i en neutral forbindelse.
5. Stabilitet:
Dannelsen af NaCl tilfredsstiller oktetreglen for både natrium og klor, hvilket gør forbindelsen mere stabil.
Derfor reflekterer formlen NaCl nøjagtigt den kemiske sammensætning og binding af natriumchlorid med et forhold mellem natrium og chlorid.
Formlen NaCl2 ville indebære, at der er to chloratomer for hvert natriumatom, hvilket ville resultere i en ubalance af ladninger og en ustabil forbindelse.
 Varme artikler
Varme artikler
-
 Forskere demonstrerer nye måder at opnå selektivitet for biomarkører inden for bioelektronikErin Ratcliff, venstre, og bachelorstuderende Zachary Kushlan undersøger en organisk halvleder tynd film fremstillet i Ratcliff -laboratoriet. Kredit:University of Arizona Ingeniører ved Universit
Forskere demonstrerer nye måder at opnå selektivitet for biomarkører inden for bioelektronikErin Ratcliff, venstre, og bachelorstuderende Zachary Kushlan undersøger en organisk halvleder tynd film fremstillet i Ratcliff -laboratoriet. Kredit:University of Arizona Ingeniører ved Universit -
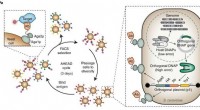 Nyt værktøj har til formål at bekæmpe COVID-19, andre sygdommeFig. 1:Autonom hypermutation gæroverfladevisning (AHEAD). en, Skema for den hurtige udvikling af højaffinitetsbinding ved hjælp af AHEAD. Ab, antistoffragment; DNAP, DNA-polymerase; HA, hæmagglutinin
Nyt værktøj har til formål at bekæmpe COVID-19, andre sygdommeFig. 1:Autonom hypermutation gæroverfladevisning (AHEAD). en, Skema for den hurtige udvikling af højaffinitetsbinding ved hjælp af AHEAD. Ab, antistoffragment; DNAP, DNA-polymerase; HA, hæmagglutinin -
 Reparation og regenerering af perifere nerver mulig med dobbelt polymer hydrogel klæbemiddelVævsteknik samler videnskabelige og medicinske eksperter inden for biomedicinsk teknik, materiale videnskab, molekylær og cellulær biologi, og genteknologi. Kredit:Mary Ann Liebert, Inc., forlag
Reparation og regenerering af perifere nerver mulig med dobbelt polymer hydrogel klæbemiddelVævsteknik samler videnskabelige og medicinske eksperter inden for biomedicinsk teknik, materiale videnskab, molekylær og cellulær biologi, og genteknologi. Kredit:Mary Ann Liebert, Inc., forlag -
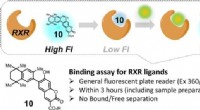 Syntetisk forbindelse giver hurtig screening for potentielle lægemidlerFluorescensen fra forbindelse 10 stiger, når en RXR-målretningsligand fortrænger den, hvilket gør det til en nyttig indikator for ligandaktivitet i assays. Kredit:Okayama University En simpel anal
Syntetisk forbindelse giver hurtig screening for potentielle lægemidlerFluorescensen fra forbindelse 10 stiger, når en RXR-målretningsligand fortrænger den, hvilket gør det til en nyttig indikator for ligandaktivitet i assays. Kredit:Okayama University En simpel anal
- Forskere får det mest realistiske billede endnu af en proteinstruktur med spikes af coronavirus
- Seksuel selektion:Hvorfor foretrækker kvinder udsmykkede mandlige signaler?
- Hvordan ville du overleve på Mars?
- Hvad er den kemiske ligning for mursten?
- Den anden mindste planet tættest på solen?
- Resultater kan hjælpe forskere med at forstå, hvor meget kuldioxid der kan frigives, mens den stad…


